
如图是现今常规生产发烟硫酸和硫酸的流程图
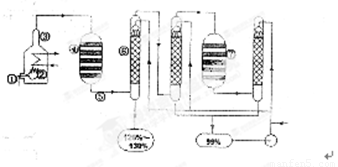
(1)在④处二氧化硫被催化成三氧化硫,④的设备名称是 。该处发生反应的方程式为 。为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是 。
(3)⑤处气体混合物主要是氮气和三氧化硫。此时气体经过⑥后不立即进入⑦是因为
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配置成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧。试说明为何这种燃烧方式对环境保护是有利的? 。
化学反应式或方程式未配平的均扣1分
(1)接触室 (2分) 2SO2+O2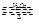 2SO3
(2分,“V2O5”写成“催化剂”也可;无条件得1分;无“
2SO3
(2分,“V2O5”写成“催化剂”也可;无条件得1分;无“ ”不得分)
等温过程(2分)
”不得分)
等温过程(2分)
(2)该反应为可逆反应,二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境(2分,“提高原料利用率”1分,“保护环境” 1分)
(3)通过吸收塔⑥后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行。(2分,“SO3含量较多”1分,“不利于SO2的催化氧化”1分)
(4)0.066 (3分,上下差0.001均可)
(5)在高温下,空气的氮气和氧气反应生成氮氧化物,有污染。低温下,氮氧化物被还原,生成N2,对环境保护有利。(2分,“生成氮氧化物”1分,“氮氧化物被还原”1分)
【解析】
试题分析:生产发烟硫酸和硫酸一般经过三个过程:沸腾炉燃烧→接触室氧化→吸收塔吸收,即先把含硫的矿石在沸腾炉内充分燃烧,然后将产生的SO2通入接触室内,在高温高压催化剂的条件下被氧气氧化,发生反应2SO2+O2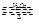 2SO3 ,将反应后的混合气体通入吸收塔,SO3被水充分吸收从而得到发烟硫酸。由上图,含硫矿石在沸腾炉中②燃烧,将混合气体通入接触室④中,SO2被O2氧化成SO3,将混合气体再通入吸收塔⑥SO3被水吸收生成硫酸,继续通入吸收塔充分吸收,然后再通入接触室使残余的SO2进一步被氧化成SO3,再通入吸收塔被水吸收。
2SO3 ,将反应后的混合气体通入吸收塔,SO3被水充分吸收从而得到发烟硫酸。由上图,含硫矿石在沸腾炉中②燃烧,将混合气体通入接触室④中,SO2被O2氧化成SO3,将混合气体再通入吸收塔⑥SO3被水吸收生成硫酸,继续通入吸收塔充分吸收,然后再通入接触室使残余的SO2进一步被氧化成SO3,再通入吸收塔被水吸收。
(1)④的设备为接触室,反应的化学方程式为: 2SO2+O2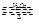 2SO3 ,该反应正反应为放热反应,为了提高SO3 的产率,不宜采取绝热条件,而应该采取等温过程。
2SO3 ,该反应正反应为放热反应,为了提高SO3 的产率,不宜采取绝热条件,而应该采取等温过程。
(2)该反应为可逆反应,二次催化使尚未反应完全的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境。
(3)⑤处气体为SO2、O2、SO3的混合气体,气体经过吸收塔⑥后SO3被水吸收,然后再进入吸收塔,使未被完全吸收的SO3再次被水充分吸收,之后混合气体中的SO3含量很少,此时再将混合气体再次通入接触室⑦,那么SO2的转化率或者SO3的产率会大大提高。
(4)1吨发烟硫酸中SO3的质量分数为20%,所以m(SO3)=0.2吨,m(H2SO4)=0.8吨,加水后,发生反应:SO3 +
H2O=H2SO4 此时需要水m(H2O)=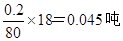 ,生成硫酸m(H2SO4)=
,生成硫酸m(H2SO4)=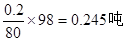 ,则总共的硫酸的质量为:m(H2SO4)=0.8+0.245=1.045吨,再配置成98%的成品硫酸时需要水的质量为m(H2O)=
,则总共的硫酸的质量为:m(H2SO4)=0.8+0.245=1.045吨,再配置成98%的成品硫酸时需要水的质量为m(H2O)=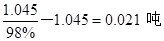 ,所以需要水的总质量m(H2O)=0.045+0.021=0.066吨。
,所以需要水的总质量m(H2O)=0.045+0.021=0.066吨。
(5)在高温下,空气的氮气和氧气反应生成氮氧化物,有污染。低温下,氮氧化物被SO2还原,生成N2,对环境保护有利。
考点:本题考查生产发烟硫酸的工艺流程。主要考察工艺流程的工艺原理和所需要的设备,工业生产与环境保护、绿色化学的关系和相关的化学计算。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:2013-2014学年湖北省襄阳市高三12月统一测试理综化学试卷(解析版) 题型:填空题
如图是现今常规生产发烟硫酸和硫酸的流程图:
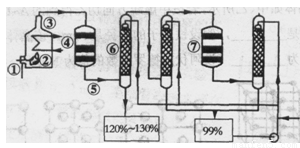
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是 .该处发生反应的方程式为 .为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是 .
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为: .
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com