
| A������pH=3��HCl��pH=11��NH3��H2O��Һ�������϶��� |
| B������Һ�����Ӽ�һ�����㣺c��NH4+��+c��H+��= c��OH-��+c��Cl-�� |
| C����������NH3��H2O����Һ������Ũ�ȿ���Ϊ��c��NH4+��>c��C1-��>c��OH-��>c��H+�� |
| D������Һ�����ɵ����ʵ���Ũ�ȡ��������HCl��Һ��NH3��H2O��Һ��϶��� |
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���� | B���� | C���� | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A�������ʾ��Һ�У�c(CH3COO-)+ c(OH-) ��c(CH3COOH)+ c(H+) |
| B�������ʾ��Һ�У�c(Na+) ��c(CH3COOH)+ c(CH3COO-) |
| C�������ʾ��Һ�У�c(Na+)> c(OH-)> c(CH3COO-)> c(H+) |
| D���ζ������п��ܳ��֣�c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��m��n | B��m��n | C��m��n | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
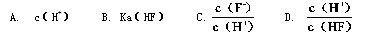
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ϡ�ͺ�x��Һ��ˮ�ĵ���̶ȱ�y��Һ��ˮ����̶�С |
| B����x��y��һԪ������ʵ���Ũ�ȵ���������Һy��pH�� |
| C����x��y���������a��ֵһ������9 |
| D����ȫ�к�x��y����Һʱ������ͬŨ��ϡ��������V(x)>V(y) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NH4++NH2�����Ը���ϵ��˵���д������ �� ��
NH4++NH2�����Ը���ϵ��˵���д������ �� ��| A��Һ����c(NH4+)��c(NH2��)�ij˻�Ϊһ���� |
| B��Һ������ﵽƽ��ʱ��c(NH3)=c(NH4+)=c(NH2��) |
| C��ֻҪ��������������c(NH4+)=c(NH2��) |
D��Һ���д���NH3��NH4+��NH2����H2O��NH3 ��H2O�����ӡ� ��H2O�����ӡ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������зų���������� | B�������зų���������� |
| C�����������ų�������һ���� | D�����������ų��������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com