
����Ŀ���Կ�ȸʯ����Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ�Ϊԭ���Ʊ�CuCl2�Ĺ���������ͼ�� 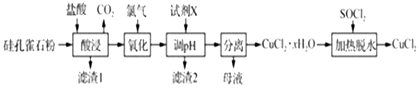
SOCl2+H2O ![]() SO2��+2HCl��
SO2��+2HCl��
��1���������ʱ������CuCO3Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ �� Ϊ��ߡ������ʱͭԪ�صĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У�
��2����������ʱ������Ӧ�����ӷ���ʽΪ ��
��3��������2������Ҫ�ɷ�Ϊ���ѧʽ��������pH��ʱ��pH���ܹ��ߣ���ԭ����
��4����������ˮ��ʱ������SOCl2��Ŀ����
���𰸡�
��1��CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ��
��2��Cl2+2Fe2+�T2Fe3++2Cl��
��3��Fe��OH��3����ֹCu2+ת��ΪCu��OH��2����
��4�����ɵ�HCl����CuCl2��ˮ��
���������⣺��1���������ʱ������CuCO3Cu��OH��2��ӦΪ���ֽⷴӦ���ɴ�ȷ��������ƽ�û�ѧ����ʽΪCuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O��Ϊ��ߡ������ʱͭԪ�صĽ����ʣ��ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣬���Դ��ǣ�CuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣻��2�����ȸʯ��Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ���������ͼ�������ᡰ���������Һ��ֻ��Fe2+�ɱ�������������������ʱ������Ӧ�����ӷ���ʽΪCl2+2Fe2+�T2Fe3++2Cl�� ��
���Դ��ǣ�Cl2+2Fe2+�T2Fe3++2Cl������3����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ��Cu2+��������Һ�У�ʵ��Cu2+��Fe3+�ķ��룬�����Ʊ�CuCl2������pH��ʱ��pH���ܹ��ߣ�����Cu2+ת��ΪCu��OH��2������
���Դ��ǣ�Fe��OH��3 ����ֹCu2+ת��ΪCu��OH��2��������4������֪��SOCl2+H2O ![]() SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣮
SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣮
���Դ��ǣ����ɵ�HCl����CuCl2��ˮ�⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ������NaCl��MgCl2��A1C13������Һ�У��ֱ���������AgNO3��Һ��ǡ�ö���ȫ��Ӧ��������������Һ�����ʵ���Ũ��֮��Ϊ
A. 1��2��3 B. 3��2��1 C. 1��1��1 D. 6��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��������ag��12C��ԭ��������bg��NA�ǰ���٤��������ֵ������˵������ȷ���ǣ� ��
A.����ԭ�ӵ����ԭ��������12 ![]()
B.����ԭ�ӵ�Ħ��������aNAg
C.Wg����ԭ�ӵ����ʵ����� ![]() mol
mol
D.Wg����ԭ��������������10W/a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��850��ʱ��ӦA��g��+B��g�� ![]() C��g��+D��g����H��0�����¶���ƽ�ⳣ��K=l��t��ʱ����һ������������У�ͨ��һ������A��B������ѧ��Ӧ��������Ũ����ʱ��仯���±���t��ʱ���ʵ�Ũ�ȣ�molL��1���仯
C��g��+D��g����H��0�����¶���ƽ�ⳣ��K=l��t��ʱ����һ������������У�ͨ��һ������A��B������ѧ��Ӧ��������Ũ����ʱ��仯���±���t��ʱ���ʵ�Ũ�ȣ�molL��1���仯
ʱ��/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��1������t��û�ѧ��Ӧ��ƽ�ⳣ����
��2��t��850�棨����ڡ�С�ڻ���ڣ����ж�������
��3����Ӧ��4min��5min֮�䣬ƽ��������������ҡ��������ƶ������ܵ�ԭ����
a������A��Ũ�� b������D��Ũ�� c����ѹ d��ʹ�ô���
��4��ij�¶��·�ӦC��g��+D��g��A��g��+B��g����ƽ��Ũ�ȷ���c��C��c��D��=2c��A��c��B�������ʱ���¶�850�棨����ڡ�С�ڻ���ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���������������ɵ�ԭ��ع���ʱ������Ϊ��Ӧʽ______������1.6gͭ�ܽ�ʱ����������________g����ԭ������Cu����64 Ag����108��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ص��о������ŵ��������ѧ��ҽѧ���������ؿ��������ᣨ�ṹ��ʽ��ͼ��ʾ��Ϊԭ�Ϻϳɣ����й����������˵������ȷ���ǣ� �� 
A.����ʽΪC15H24O2
B.���ӷ����廯����
C.�ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
D.����������ԭ�ӿ��ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ����������ȷ����(����)
A. ������ӵ����幹�����������壬����CH2Cl2�����ֲ�ͬ����
B. �����ܹ�ȼ��,��һ�������»ᷢ����ը����˼����ǿ�ȫ����Ҫ��в֮һ
C. �����������������ȡ����Ӧ����˿���ʹ��ˮ��ɫ
D. ������ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ӱ�����ǵ��������β���ŷ������������������Ҫԭ��֮һ����֪����β���ŷ�ʱ���������·�Ӧ�� 
��N2��g��+O2��g��2NO��g����H1=a kJmol��1
��2NO��g��+O2��g��2NO2��g����H2=b kJmol��1
��CO��g��+ ![]() O2��g��CO2��g����H3=c kJmol��1
O2��g��CO2��g����H3=c kJmol��1
��2CO��g��+2NO��g��N2��g��+2CO2��g����H4
��ش��������⣺
��1�����ݷ�Ӧ�٢ڢۣ�ȷ����Ӧ���С�H4=kJmol��1 ��
��2�������������ķ�Ӧ����ʾƽ�ⳣ��Kpʱ��������֣�B����ƽ��ѹǿp��B��������������ʵ���Ũ��c��B������Ӧ�ٵ�Kp=���ñ���ʽ��ʾ����
��3�����������˵����Ӧ���Ѵ�ƽ��״̬���������ţ���
A.��λʱ��������1mol NO2��ͬʱ������lmol NO
B.�ں��º��ݵ������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D.�ں��º�ѹ�������У�NO������������ֲ���
��4��̽����Ӧ����NO��ƽ��ת������ѹǿ���¶ȵĹ�ϵ���õ���ͼ1��ʾ�����ߣ��Է���ʵ�ʻ��������в����ø�ѹ��ԭ�� ��
��5��̽����Ӧ����ƽ��ʱCO2����������뷴Ӧ���� ![]() �ı�ֵ���¶ȵĹ�ϵ���õ���ͼ2��ʾ�����ߣ�
�ı�ֵ���¶ȵĹ�ϵ���õ���ͼ2��ʾ�����ߣ�
����X��Y��Z�����У�CO��ת���ʴӴ�С��˳���� ��
�������������������䣬����ͼ2�У������¶�ΪT2��T2��T1��ʱ�ı仯�������ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������һ����ͬ���ǣ�������
A.1gH2 �� 8gO2
B.150�桢1.01��105Pa ʱ��18LH2O�� 18LCO2
C.0.1 molHCl��2.24LHe
D.��״���£�2.24LCCl4��6.02��1022��CO����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com