
| A. | 氯乙烷是由碳、氢、氯三种元素组成的化合物 | |
| B. | 氯乙烷是由2个碳原子、5个氢原子和1个氯原子构成的 | |
| C. | 氯乙烷用于冷冻麻醉与其沸点较低,易挥发吸热有关 | |
| D. | 氯乙烷中碳、氢、氯三种元素的质量比为48:10:7l |
分析 A.根据氯乙烷化学式的含义进行分析判断;
B.根据氯乙烷分子的构成进行分析判断;
C.根据氯乙烷沸点低,易挥发吸热;
D.根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
解答 解:A.由氯乙烷的化学式可知,氯乙烷是由碳、氢、氯三种元素组成的,故A正确;
B.1个氯乙烷分子是由2个碳原子、5个氢原子和1个氯原子构成的,共含8个原子,故B错误;
C.氯乙烷沸点低,易挥发吸热,课用于冷冻麻醉,故C正确;
D.氯乙烷中碳、氢、氯三种元素的质量比为(12×2):(1×5):(35.5×1)=48:10:71,故D正确;
故选B.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新的能源 | B. | 合成新的物质 | ||
| C. | 研究物体运动规律 | D. | 防治环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
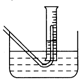 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.
小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④表示的是阳离子 | |
| B. | ?①③属于同种元素,?②④属于另一种元素 | |
| C. | ?②④形成的化合物是Al2O3 | |
| D. | ①③的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数与反应物或生成物的浓度变化无关,温度越高,平衡常数越大 | |
| B. | 25℃时,Mg(OH)2固体在同体积、同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者较小 | |
| C. | 25℃时NH4Cl溶液中的Kw大于100℃时NaCl溶液中的Kw | |
| D. | 2S℃时,H2SO3溶液的一级电离常数为Ka,则NaHSO3溶液的水解常数Kb=$\frac{Kw}{Ka}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com