
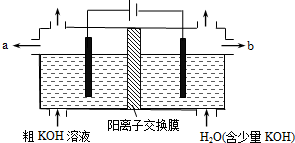
 ( )
( )| A. | 阳极反应式为4OH--4e-=2H2O+O2↑ | B. | 通电后阴极区附近溶液pH会增大 | ||
| C. | K+通过交换膜从阴极区移向阳极区 | D. | 纯净的KOH溶液从b出口导出 |
分析 用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,阴极:4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大.在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液.
解答 解:A.电解除杂过程相当于电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,故A正确;
B.电解时,阴极电极反应式为:4H++4e-=2H2↑,氢离子浓度减小,溶液的pH增大,故B正确;
C.用氯化钾制备氢氧化钾时,阴极上氢离子放电,阳极上氯离子放电,K+通过交换膜从阳极区移向阴极区,故C错误;
D.在b电极附近产生氢氧根离子,钾离子向b电极移动,所以除去杂质后氢氧化钾溶液从液体出口b导出,故D正确;
故选C.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,再结合离子移动方向确定产物,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(Cl-)=c(NH4+)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c (H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,c(Mg2+)一样大(已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11) | |
| D. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、OH-、NO${\;}_{3}^{-}$、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、SO42- | D. | Mg2+、SO42-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
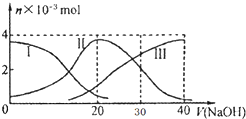 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A=H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)═c(A2-)+2 c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
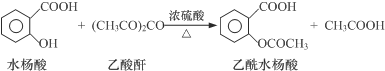
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:20 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
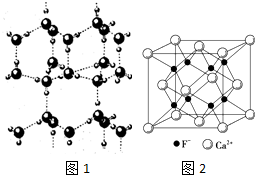 (1)下列分子中,属于平面型构型的有CD.
(1)下列分子中,属于平面型构型的有CD.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com