
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
分析 设开始的二氧化硫为xmol,氧气的物质的量为2.2mol,SO2的平衡转化率是90%,则
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△n
2 1 2 1
0.45x 0.63mol
A.恒定密闭容器中,充入稀有气体,各物质的浓度不变,平衡不移动;
B.结合v=$\frac{△c}{△t}$计算;
C.△H<0,降低温度,平衡正向移动;
D.结合反应可知,气体减少的物质的量等于参加反应的氧气的物质的量.
解答 解:A.恒定密闭容器中,充入稀有气体,各物质的浓度不变,平衡不移动,则SO2的转化率不变,故A错误;
B.0~6 min的平衡反应速率:v(O2)=$\frac{△c}{△t}$=$\frac{\frac{0.63mol}{2L}}{6min}$=0.0525mol/(L•min),故B错误;
C.△H<0,降低温度,平衡正向移动,正反应速率减小程度比逆反应速率减小程度小,故C错误;
D.开始的二氧化硫为xmol,则0.45x=0.63,解得x=1.4mol,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握减少的物质的量为参加反应的氧气的物质的量为解答的关键,侧重分析与计算能力的考查,注意平衡移动的影响因素,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取5.1gNa2CO3,加入500mL水 | |
| B. | 称取13.7gNa2CO3•10H2O,配成500mL溶液 | |
| C. | 称取5.3Na2CO3,加入500mL水 | |
| D. | 称取14.3gNa2CO3•10H2O,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同,平衡常数值为2 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
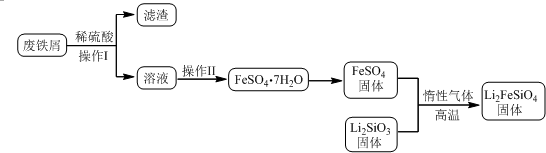
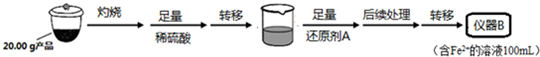
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
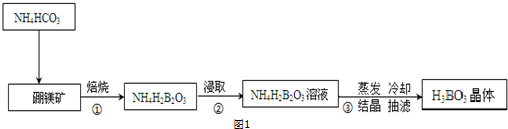
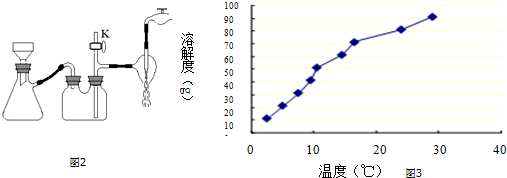
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com