
分析 浓硫酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,溶液稀释前后溶质的物质的量不变,据此计算浓硫酸体积;n(H2SO4)=1.0mol/L×0.025L=0.025mol,n(Zn)=$\frac{2g}{65g/mol}$=0.031mol>0.025mol,所以Zn剩余,以硫酸为标准计算生成氢气体积,根据H原子守恒计算生成氢气体积.
解答 解:浓硫酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,溶液稀释前后溶质的物质的量不变,由于没有350mL的容量瓶,需要500mL的容量瓶,所以浓硫酸体积=$\frac{1.0mol/L×0.5L}{18.4mol/L}$=0.027L=27mL;n(H2SO4)=1.0mol/L×0.025L=0.025mol,n(Zn)=$\frac{2g}{65g/mol}$=0.031mol>0.025mol,所以Zn剩余,以硫酸为标准计算生成氢气体积,根据H原子守恒得V=n(H2)Vm=n(H2SO4)Vm=0.025mol×22.4L/mol=0.56L,
答:需要浓硫酸的体积是27mL,生成氢气体积是0.56L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,注意第二问必须进行过量计算,易漏掉过量计算而导致错误,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
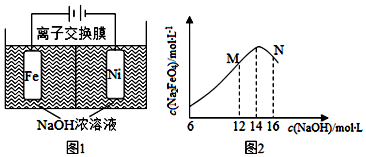
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
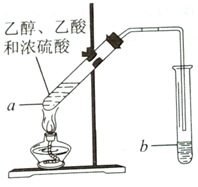 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com