
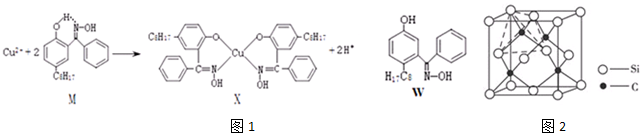
分析 (1)X难溶于水、易溶于有机溶剂,符合分子晶体的性质;
(2)非金属性越强第一电离能越大,同周期随原子序数增大元素第一电离能增大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;结合杂化轨道数目判断杂化方式;
(3)酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键;
(4)分子内氢键的存在,导致水溶性减小,物质与水分子之间形成氢键,可以增大溶解性;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中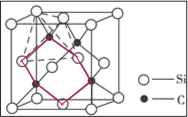 红线连接的原子,为椅式结构;
红线连接的原子,为椅式结构;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,据此算晶胞棱长,根据均摊法计算晶胞中Si、C原子数目,表示出晶胞的质量,再根据ρ=$\frac{m}{V}$计算晶体密度;
Si、C原子之间形成共价键,原子间距小于二者原子半径之和,计算的体积比实际体积偏大.
解答 解:(1)X难溶于水、易溶于有机溶剂,符合分子晶体的性质,故X为分子晶体,故答案为:分子;
(2)非金属性越强第一电离能越大,同周期随原子序数增大元素第一电离能增大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C>H,
由结构简式可知N原子共形成3对共价键,其中1个为配位键,没有孤对电子,杂化轨道数目为3,故N原子采取sp2杂化,
故答案为:O>N>C>H;sp2杂化;
(3)M中酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键,故选:be;
(4)由于M能形成分子内氢键,使溶解度减小,故答案为:M能形成分子内氢键,使溶解度减小;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中 红线连接的原子,为椅式结构,
红线连接的原子,为椅式结构,
故答案为:椅;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,则与硅原子次近的第二层有12个原子,
故答案为:12;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,故晶胞棱长为(a×10-8cm+b×10-8cm)×4÷$\sqrt{3}$,晶胞中C原子数目为4,Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{12+28}{{N}_{A}}$g,故晶体密度为4×$\frac{12+28}{{N}_{A}}$g÷[(a×10-8cm+b×10-8cm)×4÷$\sqrt{3}$]3=$\frac{160}{{N}_{A}×[\frac{4(a+b)}{\sqrt{3}}×1{0}^{-8}]^{3}}$g/cm3,
密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切是相交,碳、硅原子间的距离比两个原子半径之和小,
故答案为:$\frac{160}{{N}_{A}×[\frac{4(a+b)}{\sqrt{3}}×1{0}^{-8}]^{3}}$;密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切是相交,碳、硅原子间的距离比两个原子半径之和小.
点评 本题是对物质结构与性质的考查,涉及晶体类型与性质、电离能、杂化方式判断、化学键、晶胞结构与计算等,(5)中问题为易错点、难点,是对学生综合能力的考查,难度较大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
A.向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝
B.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性
D.向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为94、中子数为144的钚(Pu)原子:14494Pu | |
| B. | H2O2的电子式: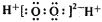 | |
| C. | S2-离子结构示意图: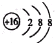 | |
| D. | 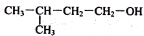 的名称2-甲基-4-丁醇 的名称2-甲基-4-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
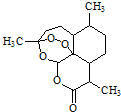
| A. | 青蒿素分子式为C15H20O5 | |
| B. | 可用蒸馏水提取植物中的青蒿素 | |
| C. | 青蒿素在碱性条件下易发生水解反应 | |
| D. | 青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
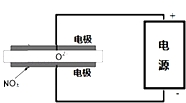 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com