
| A. | 加醋酸钠固体 | B. | 加HCl溶液 | C. | 加Ba(OH)2溶液 | D. | 加氨水 |
分析 锌足量,则生成氢气由硫酸决定,为了减慢反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变硫酸的物质的量,以此来解答.
解答 解:A.加醋酸钠固体,生成醋酸,氢离子浓度降低,反应速率减小,醋酸进一步与锌反应,生成氢气的量不变,故A正确;
B.加HCl溶液,生成氢气的量增多,故B错误;
C.加入少量Ba(OH)2溶液,消耗硫酸,溶液生成氢气的总量减小,故C错误;
D.加入氨水,消耗硫酸,溶液生成氢气的总量减小,故D错误.
故选A.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Zn过量,生成氢气由硫酸决定,把握浓度、温度、原电池对反应速率的影响即可解答,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管垂直试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.0 mol/L | B. | 15 mol/L | C. | 1.2 mol/L | D. | 0.9 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应生成NaClO转移的电子数为0.1NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为NA | |
| C. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,足量Fe与22.4LCl2反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
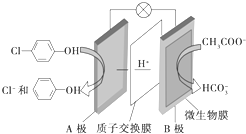 含乙酸钠和对氯酚
含乙酸钠和对氯酚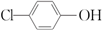 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )| A. | B极是电池的正极 | |
| B. | H+向A极移动 | |
| C. | B极的电极反应式为CH3COO-+8e-+4H2O═2HCO3-+9H+ | |
| D. | 此电池可以在高温下使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 原电池的正极和电解池的阴极所发生的反应都是还原反应 | |
| C. | 电解精炼铜时粗钢作阳极、精铜作阴极、溶液中含有铜离子 | |
| D. | 在铁制品上镀锌的方案设计是锌作阳极、镀件作阴极、溶液中含有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②③④均属于氧化还原反应 | |
| B. | 反应①中的单质C为还原剂 | |
| C. | 反应④中CaCO3既是氧化剂又是还原剂 | |
| D. | 反应①②③④所属的基本反应类型依次为:置换、复分解、化合、分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 盐酸滴入氢氧化钡溶液中:H++OH-=H2O | |
| D. | 氯气通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com