
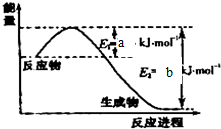
 某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )| A、该反应的△H>0 |
| B、E1表示正反应的活化能 |
| C、E2表示逆反应的活化能 |
| D、使用催化剂降低正反应的活化能,不能降低逆反应的活化能 |


科目:高中化学 来源: 题型:
| A、新制氯水呈黄绿色 |
| B、新制的氯水中只含Cl2和H2O分子 |
| C、新制氯水需置于无色试剂瓶中保存 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,44 g C3H8中含有的碳碳单键数为3NA |
| B、1mol羟基中电子数为10NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间 |
| B、将lmol N2和H2 3mol充分反应达到平衡时,放出的热量等于92.4kJ |
| C、平衡时增大氮气的浓度,达新平衡时N2转化率减小,H2转化率增大 |
| D、当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素从上到下,金属性逐渐增强 |
| B、主族元素的最高正化合价均等于它所在的主族序数 |
| C、同周期的元素(稀有气体例外)的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、MnO4-、SO42- |
| B、Cl-、Al3+、AlO2-、Na+ |
| C、Na+、CH3COO-、H+、K+ |
| D、K+、I-、Na+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
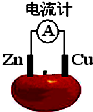 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com