
元素周期表是学习化学的重要工具,它隐含许多信息和规律。
下列元素:氧、镁、铝、硫、氯。
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分)。
(2)铝原子的原子结构示意图为 ;
(3)比较这五种元素的原子半径从大到小: (填元素符号)
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(5)镁、氯形成的化合物中含有 键。
科目:高中化学 来源: 题型:
在120℃时,甲烷和丁烷的混合物1体积与4体积的O2在密闭容器中充分燃烧,反应
后恢复到原温度,压强为原来的1.1倍,则混合气体中丁烷的体积分数是( )。
A.20℅ B.33.3℅ C.40℅ D.66.7℅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的制备合理的是( )
①将氯化铝与硫化钾溶液混合后过滤来制备硫化铝②将过量的铁与氯气加热反应制备氯化亚铁③在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜⑤将45mL冰加入到盛有5g氯化钠的烧杯中,溶解配制50g质量分数为5%的氯化钠溶液
A.只有④ B.只有②③ C.只有③④ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R是1~18号元素中的四种元素,它们的原子结构有以下特点:
①元素X原子的M层比L层少3个电子;
②元素Y的2价阴离子的核外电子排布与氖原子相同;
③元素Z原子的L层比M层多5个电子;
④元素R原子的L层比K层多3个电子,其中金属性最强的是( )
A.X B.Y C.Z D.R
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是
A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式:
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是 (选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是 。滤渣的主要成分是 、 。
(4)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果 。(选填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
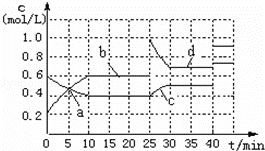
已知:2M(g)⇌ N(g);△H<0.现将M和N的混和
气体通入体积为1L的恒温密闭容器中,反应体系中各物质
的浓度随时间变化关系如图所示.下列说法正确的是:
|
| A. | a、b、c、d四个点中处于平衡状态的点是a、b |
|
| B. | 反应进行至25min时,曲线发生变化的原因是加入了 0.4mol N |
|
| C. | 若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
|
| D. | 若40min后出现如图所示变化,则可能是加入了某种催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com