
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为 。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
(1)CH3OH(l)+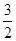 O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)
O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)
(其中化学方程式完全正确 给2分、 △H=-726.6 J/mol 给1分)
(2)①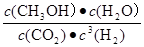 ( 2分)
( 2分)
②0.075 mol·(L·min)-1 ( 2分,计算结果1分、单位1分);75% (2分)
③C (3分) ④ BD (4分,全对得4分,选一个对得2分,其它错误不得分)
解析试题分析:(1)由m/M可知,n(CH3OH)=1/2mol,则1/2 CH3OH (l)+3/4O2(g)==1/2CO2(g)+H2O(l) △H=—363.3kJ/mol,系数加倍可得,CH3OH(l)+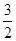 O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol;(2)①K=
O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol;(2)①K=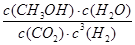 ;②读图可知,v(CH3OH)=
;②读图可知,v(CH3OH)=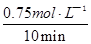 =0.075mol?L—1?min—1;由于v(H2)="3" v(CH3OH)= 0.225mol?L—1?min—1,则△n(H2)= 0.225mol?L—1?min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
=0.075mol?L—1?min—1;由于v(H2)="3" v(CH3OH)= 0.225mol?L—1?min—1,则△n(H2)= 0.225mol?L—1?min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
考点:本题考查热化学方程式、化学反应速率和化学平衡。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
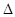 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1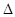 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1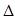 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1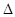 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
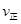 _________
_________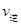 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l) △H="-1366.8" kJ/mol
②2H2 (g)+O2 (g)=2H2O(l) △H="-571.6" kJ/mol
(1)写出由CO2和H2 反应合成CH3CH2OH (l)和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。通入乙醇燃气的一极为 极,该极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图: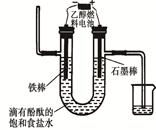
该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0·30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB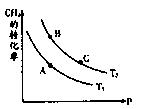
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知体积为2L的恒容密闭容器中发生反应: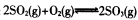 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2 mol SO2(g)和2 mol O2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____,此时,该密闭容器内混合气体的压强是反应前的____倍。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①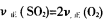
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是( )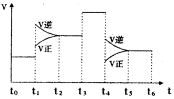

据图分析:你认为t3时改变的外界条件可能是 ;
t6时保持体积不变向体系中充人少量SO3,再次平衡后
SO2的体积百分含量比t6时 (填“大”\“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应。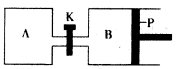
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转
化率为____
②若打开K,一段时间后重新达到平衡,容器B的体积为 __L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
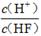 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是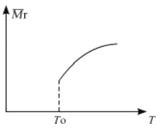
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com