
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
分析 A.所干燥的物质不能与干燥剂发生反应;
B.氢氧化铁胶体为红褐色液体,具有丁达尔现象;
C.碳酸钠受热不分解;
D.二氧化硅和氢氟酸反应是二氧化硅的特殊性质,两性氧化物是指和酸碱都反应的氧化物;
解答 解:A.H2、SO2、CO2三种气体和浓硫酸不反应,都可用浓硫酸干燥,故A正确;
B.氢氧化铁胶体为红褐色液体,透明,能发生丁达尔现象,故B错误;
C.在酒精灯加热条件下,NaHCO3固体能发生分解,Na2CO3受热不分解,故C错误;
D.二氧化硅和氢氟酸反应是二氧化硅的特殊性质,两性氧化物是指和酸碱都反应的氧化物,二氧化硅属于酸性氧化物,故D错误;
故选A.
点评 本题考查了钠及其化合物、胶体、二氧化硅等物质的性质,注意知识积累,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
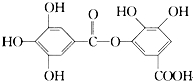
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
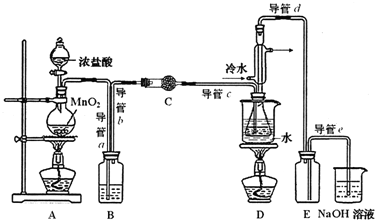
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2C12 | -76 | 138 | 1.75 | 与水反应 |
| C S2 | -109 | 47 | 1.26 | 不溶于水 |
| CC14 | -23 | 77 | 1.59 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
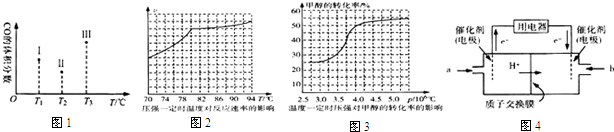
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
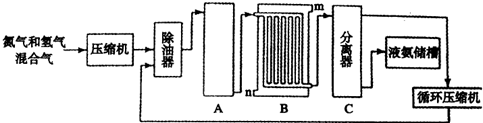
 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J•t-1 | 28109 | 38109 | 48109 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
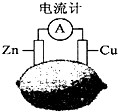
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com