
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
分析 A.降低压强,平衡向气体体积增大的方向移动;
B.根据可逆反应的特点判断;
C.升高温度平衡正向移动,平衡常数增大;
D.根据方程式判断.
解答 解:A.该反应正向为气体物质体积增大的反应,若降低压强,平衡正向移动,SiCl4的转化率增大,故A正确;
B.可逆反应的特点是不能进行到底,若反应开始时SiCl4为1 mol,则在平衡时,吸收热量小于QkJ,故B错误;
C.该反应为吸热反应,升高温度平衡正向移动,平衡常数增大,将反应的温度由T1升高至T2,则反应的平衡常数K1<K2,故C错误;
D.根据题给热化学方程式知,当反应吸收热量为0.25QkJ时,生成的HCl为1mol,恰好与1 molNaOH反应,故D正确.
故选AD.
点评 本题考查化学平衡的移动因素,为高频考点,侧重于学生的分析能力的考查,注意把握平衡移动的影响因素,难度不大.


科目:高中化学 来源: 题型:解答题
 、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.
、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 盐酸和醋酸,只要物质的量浓度相同,电离程度也相同 | |
| C. | 强电解质的稀溶液中不存在溶质分子 | |
| D. | 强电解质都是离子化合物,弱电解质都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28% | B. | 27.6% | C. | 72.4% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,某溶液中由水电离出的c(H+)=10-5 mol•L-1,则此溶液可能是盐酸 | |
| B. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为:①>②>③ | |
| C. | 0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合: c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它属于有机高分子 | B. | 它能产生“白色污染” | ||
| C. | 它形成的单体是乙烯 | D. | 聚乙烯中含有双键不稳定,易变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时阳极获得O2 | |
| B. | 电解时阴极获得海绵钛 | |
| C. | 电解时阳极有Cl2放出 | |
| D. | 电解工艺一旦投入实际生产,钛将可与不锈钢和铝合金竞争 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
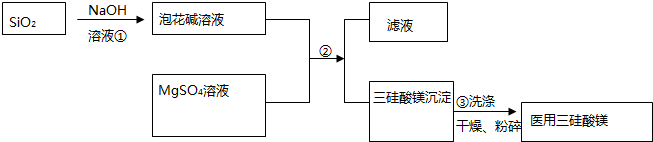
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com