
0.1 mol Mg粉分别在足量的O2、CO2、N2中燃烧,生成固体的质量依次为W1、W2、W3,则下列关系正确的是( )
A.W2>W1>W3 B.W1=W2>W3
C.W1>W2>W3 D.W3>W2>W1
科目:高中化学 来源: 题型:阅读理解
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体
积V变化如右图所示。当V1=140mL时,则金属粉末中
n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴
入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高一第二次月考化学试卷 题型:填空题
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如右图所示。当V1=140mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三上学期教学质量检测化学试卷 题型:计算题
(6分)向100 mL 1.5 mol/L稀H2SO4中加入过量Mg粉,充分反应后,滤去多余Mg粉,滤液在t℃下恒温蒸发,当滤液质量为72.0 g时开始析出MgSO4·xH2O晶体,当析出晶体12.3 g时,剩下滤液48.0 g。通过计算请回答下列问题。
(1)生成标准状况下的气体体积(请写出计算过程);
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数为 ;
(3)MgSO4·xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一第二次月考化学试卷 题型:填空题
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体
积V变化如右图所示。当V1=140mL时,则金属粉末中
n(Mg)= mol,V2= mL。
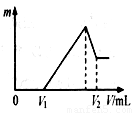
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴
入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com