
【题目】按要求回答下列各题:
Ⅰ.下列实验不能成功的是______________
A.为了检验R-X是碘代烷,将R-X与NaOH水溶液共热,经充分反应后冷却,向冷却液中加稀HNO3酸化后,再加AgNO3溶液,观察沉淀颜色
B.为检验淀粉是否水解,将淀粉与少量稀H2SO4共热一段时间,加入新制的Cu(OH)2 ,观察变化
C. 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制取银镜
D.无水乙醇与浓硫酸按1:3的体积比混合快速加热到170℃左右制取乙烯
Ⅱ.有机物M的结构简式为: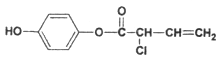 ,则:
,则:
(1)1 mol M最多消耗的H2、Br2、NaOH溶液的比值为_________________;
写出M在酸性(稀硫酸)条件下的水解反应方程式_________________________。
【答案】 BC 4:3:4 ![]() +H2O
+H2O![]()
![]() +
+![]()
【解析】Ⅰ.A、若R-X是碘代烷,将R-X与NaOH水溶液共热,将生成NaI,向冷却液中加稀HNO3酸化将剩余的NaOH反应完,再加AgNO3溶液,将生成AgI黄色沉淀,故A可以成功;B、为检验淀粉是否水解,将淀粉与少量稀H2SO4共热一段时间,若直接加入新制的Cu(OH)2 ,Cu(OH)2可能被剩余的稀H2SO4反应,故B不能成功;C、向银氨溶液中加入几滴乙醛后,应水浴加热,若用酒精灯加热至沸,Ag单质不能附着在试管壁上,故C不能成功;D、无水乙醇与浓硫酸按1:3的体积比混合,快速加热到170℃左右可以制取乙烯,故D实验能成功;故选BC;
Ⅱ、有机物M的结构简式为: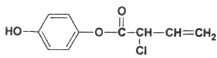 ,结构中含有1个酚羟基、1个酯基、一个氯原子、一个碳碳双键,该结构可以和H2加成,消耗4mol,可以和Br2取代酚羟基邻位消耗2mol,碳碳双键还可与Br2加成,消耗1mol,共消耗3mol,酯基可以和NaOH水解消耗1mol,水解后的酚羟基和原本有的酚羟基再消耗NaOH 2mol,氯原子也可以水解消耗1mol,共消耗4mol,故1 mol M最多消耗的H2、Br2、NaOH溶液的比值为4:3:4;M在酸性(稀硫酸)条件下的水解反应方程式为:
,结构中含有1个酚羟基、1个酯基、一个氯原子、一个碳碳双键,该结构可以和H2加成,消耗4mol,可以和Br2取代酚羟基邻位消耗2mol,碳碳双键还可与Br2加成,消耗1mol,共消耗3mol,酯基可以和NaOH水解消耗1mol,水解后的酚羟基和原本有的酚羟基再消耗NaOH 2mol,氯原子也可以水解消耗1mol,共消耗4mol,故1 mol M最多消耗的H2、Br2、NaOH溶液的比值为4:3:4;M在酸性(稀硫酸)条件下的水解反应方程式为:
![]() +H2O
+H2O![]()
![]() +
+![]() 。
。


科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)画出Fe3+的外围电子排布图:___________;SCN-的结构式为________,SCN-中σ键与π键数目之比为________。
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如右图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是___________。
![]()
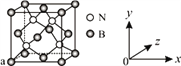
(3)N与B可形成化合物立方氮化硼,其结构与金刚石相似,是超硬材料,立方氮化硼属于________晶体。已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
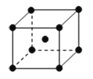
(4)单质铁的晶体结构如右图所示,该堆积方式名称为________。已知该晶胞的密度为ρg/cm3,则铁原子半径的计算式为_________ pm。
(5)磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)是两种重要试剂。磺酰氯可看成是硫酸分子中2个羟基被氯原子取代后的衍生物,主要用于有机合成;亚硫酰氯可与水剧烈反应,常用于与一些易水解的无机氯化物(MgCl2·6H2O)作用制取无水金属氯化物(MgCl2)。
已知:SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) ……(Ⅰ)
2SOCl2(g) ……(Ⅰ)
SO2(g)+Cl2(g)![]() SO2Cl2(g) ………………(Ⅱ)
SO2Cl2(g) ………………(Ⅱ)
回答下列问题:
(a)SO2Cl2的空间构型为_______________。
(b)反应Ⅰ、Ⅱ的化学平衡常数分别为K1、K2,则:SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)的平衡常数K=_______。
2SOCl2(g)的平衡常数K=_______。
(c)在50L恒容密闭容器中充入1.0molSO2和1.0molCl2发生反应Ⅱ,测得SO2的转化率随时间变化关系如右图所示。
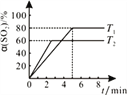
①反应Ⅱ属于________反应(填“放热”“ 吸热”)。在T1温度下,从反应开始至刚好达到平衡时的平均反应速率v(SO2)=___________。为了提高SO2的平衡转化率,除改变温度外,还可以采取的一条措施是__________。
②在T2温度下反应,起始压强为101kPa,则平衡时气体的压强p平=__________kPa。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),T2温度下,该反应的化学平衡常数Kp=______________。
(d)无水AlCl3在有机合成中应用广泛。蒸干AlCl3溶液不能得到无水AlCl3,用化学方程式表示其原因:______________。工业上常用SOCl2与AlCl3·6H2O混合并加热制备无水AlCl3,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化,回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个____________,电子除空间运动状态外,还有一种运动状态叫做____________。
(2)硒常用作光敏材料,基态硒原子的价电子排布式为_______________;与硒同周期的p区元素中第一电离能大于硒的元素有_________种。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为___________,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________________________。SnCl4分子的空间构型为_________________
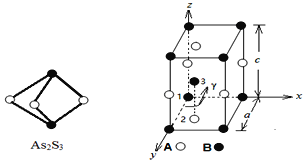
(4)某晶体的晶胞结构如上图所示,该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____________,计算上述晶体中A和B两原子间的最小核间距为_____________。(保留四位有效数字)
(5)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )
A.稀H2SO4
B.稀盐酸
C.K2SO4固体
D.KNO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说祛正确的是
A. 蛋白质是仅由碳、氢、氧、氯元素组成的一类高分子化合物
B. 可以用溴水鉴别![]() 和
和![]()
C. 用甲苯分别制取TNT、邻溴甲苯和苯甲酸所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
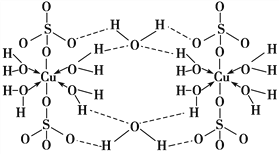
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com