
| A.sp杂化? |
| B.sp2杂化? |
| C.sp3杂化? |
| D.没有杂化,只有三个σ键 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| O—O键 数据 | 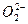 | 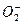 | O2 | 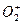 |
| 键长/10-12m | 149 | 128 | 121 | 112 |
| 键能/kJ·mol-1 | x | y | z=494 | w=628 |
| A.成键时电子数越多,键能越大 | B.键长越长,键能越大 |
| C.成键所用的电子数越少,键能越大 | D.成键时电子对越偏移,键能越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴、碘是单质,四氯化碳是化合物? |
| B.Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子? |
| C.溴、碘单质和四氯化碳中都含有卤素? |
| D.Br2、I2常温下都不是气态,CCl4也不是气态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有非极性键的分子一定是非极性分子 |
| B.非极性分子中一定含有非极性键 |
| C.由极性键形成的双原子分子一定是极性分子 |
| D.键的极性与分子的极性无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.聚合硫酸铁可用于净水,其化学式为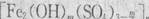 ,式中的m可能为6 ,式中的m可能为6 |
| B.将3g白色粉未完全溶于10g热水中冷却至室温析出2g晶体,再将析出的2g晶体全部溶于10 g热水中,冷却至室温析出1.5 g晶体。由此可知此白色粉末可能是纯净物也可能是混合物 |
| C.无色混合气体甲依次经过下图所示实验装置的处理,结果得到酸性溶液且最终无气体剩余.则原气体的成分可能为NH3、NO、CO2 |
| D.淀粉和纤维素的组成都是(C6H10O5)n,水解的最终产物都是葡萄糖,蛋白质是由氨基酸形成的可降解的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
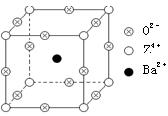
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
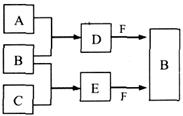
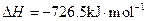 ,氢气的燃烧热
,氢气的燃烧热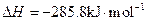 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com