
��10�֣����ڵؿ��еĺ����ϸߣ��輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣺
��1���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ�����������ͨ��������Ҫԭ���� ��
��2���ߴ������ִ���Ϣ���뵼��������Ȳ�ҵ����Ҫ�Ļ������ϣ���ҵ���ᴿ���ж���·�ߣ�����һ�ֹ�������ʾ��ͼ����Ҫ��Ӧ��ͼ��
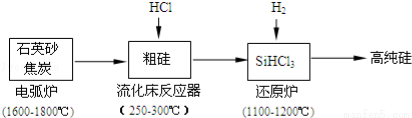
�ٹ�ҵ����ʯӢɰ�ͽ�̿�ڵ绡¯�и��¼��ȵ�1600�橁1800������ɴֹ��⣬Ҳ��������̼���裬���ڵ绡¯�ڿ��ܷ����ķ�Ӧ�Ļ�ѧ����ʽΪ ��
������������Ӧ�IJ����У�SiHCl3��Լռ85%������SiCl4��SiH2Cl2��SiH3Cl�ȣ��ֹ�����SiHCl3�Ļ�ѧ��Ӧ����ʽ ��
��3���й����ʵķе��������±����ᴿSiHCl3����Ҫ���ղ��������dz����������� ��SiHCl3����ˮ�⣬����ȫˮ��IJ���Ϊ ��
���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
�е�/�� | 2355 | 57.6 | 31.8 | 8.2 | ��30.4 | ��84.9 | ��111.9 |
��4����ԭ¯�з����Ļ�ѧ��ӦΪ�� ��
��5���ȼҵ��Ϊ�������������ṩ����ԭ�ϣ���Щԭ���� ��
��10�֣�
��1�����ʯӢ��ʯ��ʯ����1�֣�
��2����SiO2+2C Si+2CO����SiO2+3C
Si+2CO����SiO2+3C SiC+2CO������2�֣�
SiC+2CO������2�֣�
��Si+3HCl SiHCl3+H2����2�֣�
SiHCl3+H2����2�֣�
��3����������H4SiO4����H2SiO3����H2��HCl������1�֣�
��4��SiHCl3+H2 Si+3HCl����2��)
Si+3HCl����2��)
��5��H2��HCl����1�֣�
��������
�����������1��������ͨ��������Ҫԭ���д��ʯӢ��ʯ��ʯ��
��2���ٶ��������뽹̿�ڸ����·�����Ӧ���ɴֹ��̼���裬��ѧ����ʽΪSiO2+2C Si+2CO����SiO2+3C
Si+2CO����SiO2+3C SiC+2CO����
SiC+2CO����
�ڴֹ����Ȼ�����·�Ӧ��������SiHCl3����������ѧ����ʽΪSi+3HCl SiHCl3+H2
SiHCl3+H2
��3�����ݻ���������ʵķе�IJ�ͬ���ѷе�Ϊ31.8���������������ɵõ�SiHCl3�����Թ��ղ��������dz���������������SiHCl3����ˮ�⣬����SiHCl3��Ԫ�صĻ��ϼۿ�֪����ȫˮ��IJ���ΪH4SiO4����H2SiO3����H2��HCl��
��4����ԭ¯�ڣ�������SiHCl3����������ԭ��Ӧ������Si��HCl����ѧ����ʽΪSiHCl3+H2 Si+3HCl��
Si+3HCl��
��5��������Ӧ����Ҫ������HCl�����ȼҵ���Եõ����������������Կ��ṩ������HCl��
���㣺����Թ������̵ķ�������ѧ����ʽ����д



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���ǣ���
A�������������£�CH3CO18OC2H5��ˮ�������CH3CO18OH��C2H5OH
B���øʰ���ͱ��������������γ�4�ֶ���
C������ʽΪC5H8O2,������Na2CO3��Һ��Ӧ������������Ȼ�̼��Һ��Ӧ���л�����8��
D�����ᱡ�ɴ�����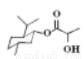 �����ܷ���ˮ�⡢��������ȥ��Ӧ
�����ܷ���ˮ�⡢��������ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�������������ۿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֶ�����Ԫ�ص�ijЩ�������±���ʾ:
Ԫ�ش��� | X | W | Y | Z | Q |
ԭ�Ӱ뾶����10-12 m�� | 37 | 99 | 66 | 104 | 154 |
��Ҫ���ϼ� | +1 | -1��+7 | -2 | -2��+6 | +1 |
����˵����ȷ���ǣ� ��
A����Q��Y�γɵĻ�������ֻ�������Ӽ�
B��Z��X֮���γɵĻ�������л�ԭ��
C��X��YԪ����ɵĻ�����ķе����X��ZԪ����ɻ�����ķе�������Y�ǽ����Ա�Zǿ
D��Y��Q��W����Ԫ����ɻ������ˮ��Һһ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
(15��)ijͬѧ����������ƺϳɿ�������I�߷��ӻ�����G·�����£�
��֪����A�����к���3���� ��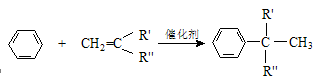
��ش��������⣺
��1��C�ķ���ʽΪ �� A������Ϊ ��
��2����Ӧ�ٵķ�Ӧ����Ϊ ��G�Ľṹ��ʽΪ
��3��д��D������Cu(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ��
��4��������Ӧ������ȡ����Ӧ���� ������ţ�
��5��F���ڶ���ͬ���칹�壬д��������������������ͬ���칹��
���ܷ���ˮ�ⷴӦ������ʹ������Ȼ�̼��Һ��ɫ �ں˴Ź���������ʾ��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A��Na2O2����ˮ�Ʊ�O2��2O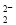 ��2H2O=4OH����O2��
��2H2O=4OH����O2��
B����ϡ����ϴ���Թ��ڱڵ�������Ag+2H��+NO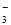 =Ag��+NO��+H2O
=Ag��+NO��+H2O
C����Ba(OH)2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2����2OH����2H����SO ��BaSO4����2H2O
��BaSO4����2H2O
D�� ������Һ��ͨ������CO2��2C6H5O- + CO2 + H2O  2C6H5OH + CO
2C6H5OH + CO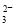
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H2(g��+  O2(g) �T H2O(g) ��H1=��241.8kJ?mol��1��C(s)+
O2(g) �T H2O(g) ��H1=��241.8kJ?mol��1��C(s)+  O2(g) �T CO(g) ��H2=��110.5kJ?mol��1���ɴ˿�֪��̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C(s)+H2O(g) �T CO(g)+H2(g) ��H3�����H3Ϊ
O2(g) �T CO(g) ��H2=��110.5kJ?mol��1���ɴ˿�֪��̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C(s)+H2O(g) �T CO(g)+H2(g) ��H3�����H3Ϊ
A��+131.3 kJ?mol��1
B����131.3 kJ?mol��1
C��+352.3 kJ?mol��1
D����352.3 kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ����ȷ����
A��������Һ�м�������������þ���壺Mg��OH��2+2CH3COOH�TMg2++2CH3COO��+2H2O
B��H2O2��Һ�м�����������KMnO4��Һ��2MnO4��+3H2O2+6H+�T2Mn2++6H2O+4O2��
C��Ca��HCO3��2��Һ�м�����������ʯ��ˮ��Ca2++HCO3��+OH���TCaCO3��+H2O
D��NH4HSO4��ϡ��Һ����μ���Ba��OH��2��Һ��SO42��ǡ�ó�����ȫ��NH4++H++SO42��+Ba2++2OH��=NH3?H2O+BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ������
��12 �֣����������Ҫ�ɷ�ΪFeTiO3(�ɱ�ʾΪFeO��TiO2)����������MgO��CaO��SiO2�����ʡ������������Ʊ�����ӵ�ص缫����(�����Li4Ti5O12�����������LiFePO4)�Ĺ�ҵ��������ͼ��ʾ��
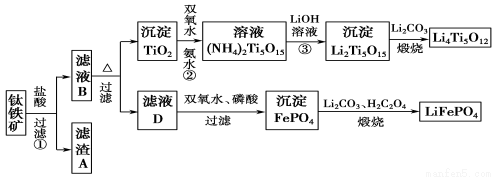
��֪��FeTiO3�����ᷴӦ�����ӷ���ʽΪ��FeTiO3��4H����4Cl��===Fe2����TiOCl42����2H2O��
��1������ʵ���������չ���������õ����ֹ������ʵ������������������ƾ��ơ��������⣬���� (����������)�������ж���漰��������ϴ�ӳ����ķ����� ��
��2����������������A�Ʊ��뵼��ķ�Ӧ�� ��
��3����ҺB��TiOCl42��ת������TiO2�����ӷ���ʽ�� ��
��4����Ӧ���й���TiO2ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶��йأ���Ӧ�¶ȹ���ʱ��TiԪ�ؽ����ʻ��½�����ԭ���� ��
��5��д������ҺD����FePO4�����ӷ���ʽ ������ҺD�Ʊ�LiFePO4�Ĺ����У�����˫��ˮ��H2C2O4�����ʵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ�����������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ������ȡ����N2�����õķ�Ӧ��NaNO2��NH4Cl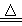 NaCl��N2����2H2O�����ڸ÷�Ӧ��˵����ȷ����
NaCl��N2����2H2O�����ڸ÷�Ӧ��˵����ȷ����
A��NaNO2�ǻ�ԭ��
B������1molN2ʱת�Ƶĵ���Ϊ6mol
C��NH4Cl�е�NԪ�ر�����
D��N2�������������ǻ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com