
| A. | 100毫升的溶液中含有Mg2+、CI-总数为0.3 NA | |
| B. | 100毫升的溶液中含有Mg2+数目是O.1NA | |
| C. | 2升溶液中Mg2+的浓度是0.3mol/L | |
| D. | 1.5升溶液中含有CI-的浓度是4.5mol/L |
分析 A.根据n=cV计算MgCl2的物质的量,每个MgCl2含有1个Mg2+、2个Cl-,再根据N=nNA计算Mg2+、C1-总数;
B.根据n=cV计算MgCl2的物质的量,每个MgCl2含有1个Mg2+;
C.溶液具有均一性,1个MgCl2含有1个Mg2+,Mg2+的浓度等于MgCl2的浓度;
D.溶液具有均一性,1个MgCl2含有2个Cl-,Cl-的浓度是MgCl2的浓度的2倍.
解答 解:A.100mL的溶液中含有Mg2+、C1-总数为0.1L×0.3mol•L-1×3×NAmol-1=0.09NA,故A错误;
B.若镁离子不水解,则100mL的溶液中含有Mg2+数目为0.1L×0.3mol•L-1×NAmol-1=0.03NA,镁离子为弱碱阳离子,在溶液中水解,所以溶液中镁离子数小于0.03NA,故B错误;
C.溶液具有均一性,浓度与体积无关,1个MgCl2含有1个Mg2+,Mg2+的浓度等于MgCl2的浓度,所以Mg2+的浓度是0.3mol•L-1,故C正确;
D.1个MgCl2含有2个Cl-,Cl-的浓度是MgCl2的浓度的2倍,所以溶液中Cl-的浓度是0.6mol•L-1,故D错误;
故选:C.
点评 本题考查了溶液物质的量浓度概念的理解及有关计算,明确溶质中所含离子个数是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
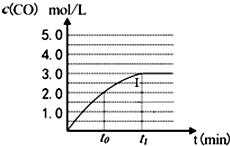 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
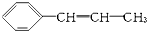 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ①②④ | D. | ①⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com