
| A.钢铁发生电化腐蚀的正极反应式:Fe-2e-="=" Fe2+ |
| B.为实现铁上镀铜,可让铁做阳极. |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-==Cl2↑ |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
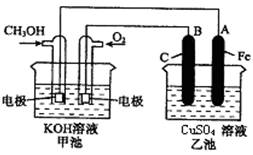
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
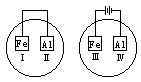
| A.II和Ⅳ | B.Ⅱ和Ⅲ | C.Ⅰ和Ⅲ | D.Ⅰ和Ⅳ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电镀时,镀件接电源的正极,电镀材料接电源负极 |
| B.在船身上装锌块可避免船体遭受腐蚀 |
| C.充电时,把铅蓄电池的负极接在外电源的正极 |
| D.碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e—= 4OH— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
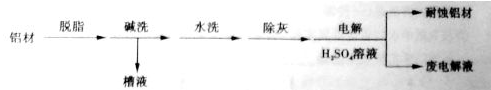
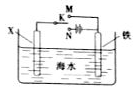
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。 Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。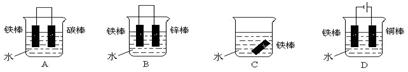
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
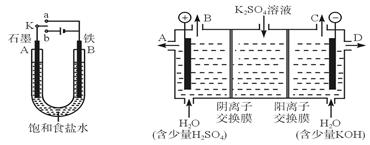
 4SiHCl3(g)
4SiHCl3(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com