

分析 (1)根据温度对化学平衡的影响来判断反应的吸放热情况;
(2)对于放热反应,温度越高,平衡常数越小;
(3)根据化学反应前后压强之比等于物质的量之比来计算;
(4)①由图可知甲醇燃料电池是电源,氧气是氧化剂在正极发生还原反应,则另一电极为负极;
②根据电子守恒进行计算;
(5)根据盖斯定律来计算反应的焓变并书写热化学方程式.
解答 解:(1)根据图示信息,当达到化学平衡以后(甲醇含量的最高点),升高温度,甲醇的体积分数减小,说明平衡逆向移动,所以该反应是一个放热反应,
故答案为:<;
(2)对于放热反应,升高温度,K减小,故答案为:<;
(3)根据题意得到:CO(g)+2H2(g)?CH3OH(g)
初始物质的量(mol) 2.5 7.5 0
变化的物质的量(mol) 2.25 4.5 2.25
平衡的物质的量 (mol)0.25 3 2.25
所以此时容器内的压强和开始时的比值为:$\frac{0.25+3+2.25}{2.5+7.5}$=0.55,
故答案为:0.55;
(4)①由图可知,甲醇燃料电池中通入氧气的为正极,b为电池的负极,
故答案为:负;②根据Cu电极反应:Cu=2e-+Cu2+,当铜片的质量变化为12.8g时,转移电子是0.4mol,
a极上电极反应:O2+4e-+2H2O-═4OH-,转移电子是0.4mol时,消耗的O2在标准状况下的体积为2.24L,
故答案为:2.24;
(5)①2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H1=+1411.0kJ/mol
②2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H2=+1366.8kJ/mol
根据盖斯定律反应C2H4(g)+H2O(l)═C2H5OH(l)等于②-①,所以△H=△H2-△H1=-44.2 kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH,△H=-44.2 kJ/mol.
点评 本题考查学生有关电化学、热化学以及化学平衡的有关计算等综合知识,可以根据教材知识来回答,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
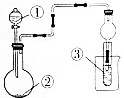 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | ③中的现象 |
| A | 浓盐酸 | Na2SO3 | BaCl2溶液 | 出现浑浊 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 出现红色 |
| D | 醋酸 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节约能源,提高能源利用率 | |
| B. | 大量开采化石原料,以满足社会对能源的要求 | |
| C. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| D. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
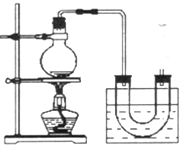 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g CO中含有的分子数为NA | |
| B. | 1.0 mol•L-1 Na2SO4溶液中所含的Na+数为2NA | |
| C. | 标准状况下,22.4 L HCl气体中所含的原子数为NA | |
| D. | 1 mol N2所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
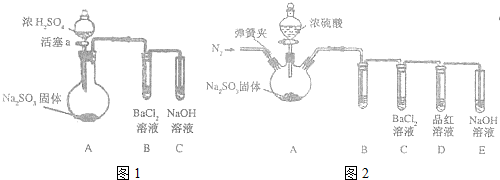
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com