
(6分)把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
(1)0.75 mol·L-1 (2)20% (3)X=3
解析试题分析:(1)由方程式可知每产生2mol的 C,反应会消耗3mol的A。由于反应经过5 min后达到化学平衡,此时生成2 molC,则反应消耗了3mol的A。此时还有A3mol。则c(A)=3mol÷4L=0.75 mol/L.由方程式可知若A反应3mol,则B反应了1mol.所以B的转化率="(1mol÷5" mol)×100%=20%.(3)V(D)= 0.15 mol/( L·min),n(D)= V(D)×Δt=0.15 mol/( L·min)×4L×5 min=3mol。2:X=2:3.所以X=3.
考点:考查不同物质的化学反应速率的关系、计算及化学方程式的确定的知识。


科目:高中化学 来源: 题型:填空题
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

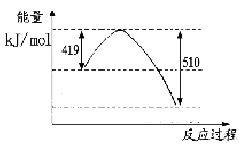 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(18分)钛被誉为“二十一世纪的金属”,用途广泛。按下图所示组成的产业链可以大大提高资源利用率并能减少环境污染。请回答下列问题:
(1)已知中FeTiO3元素的化合价为+3,钛铁矿经氯化法得到四氯化钛的过程中________元素被氧化,每生产1. 9kgTiCl4消耗Cl2在标准状况下的体积为________L。
则金属Mg还原TiCl4制取金属Ti (s)的热化学方程式为___________.
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。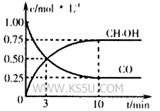
则从反应开始到建立平衡,v(H2)为___________ ;
该温度下 的化学平衡常
的化学平衡常
数为___________ 。
。
②在其它条件不变,只改变其中的一个条件,该小组同学
根据实验绘制如下图像,其中与事实相符的是为___________(填
序号)。
(4)电解饱和食盐水是氯碱工业的基础。
①电解饱和食盐水的离子方程式为为___________ 。
②电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用为为___________。(用必要的离子方程式和文字说明)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
| A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(12分)在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
⑴求20℃时,该反应的平衡常数K(保留三位有效数字)
⑵20℃时,若在同一容器中加入1molA、 mol B和 mol C,则平衡混合气中C的体积分数仍为ω。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气)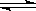 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为 ;平衡时,气体的总物质的量是 。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| | 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | | |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com