
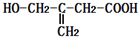 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:多选题

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
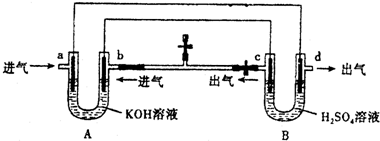
| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: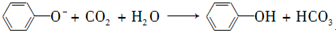 - - |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
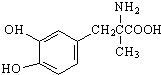
| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com