
下列醇既能被催化氧化生成醛,又能发生消去反应生成烯烃的是
A.CH3OH B.
C. D.
D.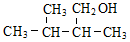
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
6.某化学反应的能量变化如下图所示。下列有关叙述正确的是

A.该反应为放热反应
B.E2可表示形成新的化学键所释放的能量
C.该反应的反应热ΔH=E1-E2
D.加入催化剂可同等程度的降低E1、E2
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al+2OH-+6H2O=2[ Al(OH)4] -+3H2↑
B.NaHCO3电离:NaHCO3 Na++ H++CO32-
Na++ H++CO32-
C.醋酸与碳酸钠反应:2H++CO32-= CO2↑+H2O
D.铜与氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:填空题
(9分)A~G有以下转化关系:

已知:①E能发生银镜反应;
②C中苯环上有三个互不相邻的取代基
③G分子遇氯化铁溶液显紫色。
(1)B的结构简式为_______________,G的结构简式为________________。
(2)C→D的反应类型是____________,E分子中含氧官能团的名称是_______________。
(3)B物质有许多同分异构体,除B外其他三种含有苯环的同分异构体的结构简式分别为
_________________、________________、__________________。
(4)D→E的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:选择题
化合物A(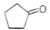 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成:
 ,则下列说法错误的是
,则下列说法错误的是
A.反应1可用的试剂是氯气
B.反应1为取代反应,反应2为消去反应
C.反应3可用的试剂是氧气和铜
D.1molA完全燃烧消耗6mol氧气
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质中既能使酸性高锰酸钾溶液又能使溴的四氯化碳溶液褪色的是
A.甲苯 B.环己烯 C.环己烷 D.聚苯乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高一上学期期期末统考化学试卷(解析版) 题型:填空题
(13分)研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2  N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2 。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2 。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为________________.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol 的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。

请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________.
②实验中需配制1.0 mol 的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
③写出图中A→B反应的离子方程式:_______________________。
④通过计算,该废水中______Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________(若不含有,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:填空题
(14分)用电化学原理研究金属铝具有重要的意义。
(1)已知:
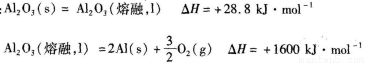
①工业上利用惰性电极电解熔融的Al2O3冶炼铝,每消耗1000kJ电能时,生成27g铝,则电解过程中能量利用率为____。

③利用Al2O3制备无水AlCl3的反应为
 。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
(2)为了防止钢材腐蚀,常采用电解熔融盐法在钢材表面镀铝。熔融盐中铝元素和氯元素仅以 形式存在。如下图所示:
形式存在。如下图所示:

①钢材表面镀铝时,铝应接电源的________极。
②试分析电镀铝时不用氯化铝水溶液作电解液的原因:_______________.
(3)铝一空气-NaOH溶液组成的铝电池性能优越,可用于电动汽车。写出该电池的负极电极反应式______:
(4)铝可用于处理银器表面的黑斑(Ag2S)。将银器置于铝制容器里的食盐水中并与铝接触,形成原电池,可将Ag2S转化为Ag,该过程中食盐水的作用为_______________.
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏回族自治区银川一中高一上学期期末考试化学试卷(解析版) 题型:选择题
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是
A.AgNO3 B.FeSO4 C.MgCl2 D.(NH4)2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com