
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| (1) | 制氧气 | H2O2→O2 | C C |
| (2) | 制氨气 | NH4Cl→NH3 | B B |
| (3) | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
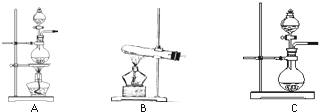 下表是实验室制备气体的有关内容:
下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C C |
| ② | 制氨气 | NH4Cl→NH3 | B B |
| ③ | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:江苏省张家港高级中学2007届高三化学综合练习 题型:022
下列实验操作或对实验事实的叙述中存在错误的是________(填序号)
A、用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1mol?L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤②定容时仰视刻度线③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体.
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有________.
②制得Al2(SO4)3与K2SO4物质的量之比小于________.
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气.在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有(填序号).
(4)碱式氯化铜(不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2O.为验证其组成并确定X值,某学生设计了以下几步实验
①取ag碱式氯化铜的晶体制成粉末.
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为bg.
③另取ag碱式氯化铜的晶体,溶于足量硝酸中,得到溶液.
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为cg.
若以上操作均正确,试回答下列问题:
A、将晶体制成粉末,所用的主要化学仪器是________(填仪器名称).以上四步中,用到玻璃棒的步骤有________(填序号)
B、步骤②灼烧后得到的固体应为:________.
C、步骤④主要包括:加入足量硝酸银溶液→________→________→晾干→称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com