
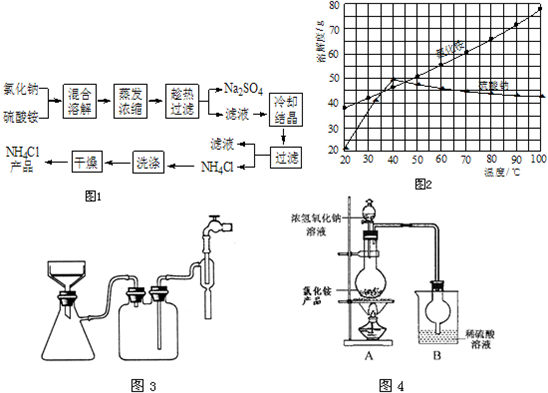
 =0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为
=0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为 ×100%=25%,故答案为:25%.
×100%=25%,故答案为:25%.

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
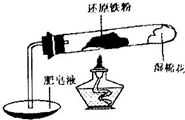 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.根据上述实验,下列推断正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
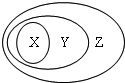 用下图表示的一些物质或概念间的从属关系中不正确的是
用下图表示的一些物质或概念间的从属关系中不正确的是| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 含氧酸 | 酸 | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
某无色澄清溶液含有以下离子中的若干种:Na+、NH4+、Cu2+、Fe3+、Ca2+、Cl-、SO42-、CO32-,现分别取2份200mL该溶液进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加足量NaOH溶液并加热 | 收集到气体2.24L(已折算成标准状况下的体积) |
| ② | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为12.54g,第二次称量读数为4.66g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______.
(2)试写出实验①发生反应的离子方程式______.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol?L-1) |
| ______ | ______ |
| ______ | ______ |
| ______ | ______ |
(4)判断混合物中是否存在Na+并说明理由?______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com