
【题目】(1)写出下图中序号①~④仪器的名称:

① ;② ; ③ ;④ ;(填仪器序号)
(2)上述①~④四种仪器中,使用前必须检漏的是_。(填仪器序号)
(3)分离碘水中的碘应先选择装置 (填装置序号)进行 和 操作 ,再用装置 (填装置序号)进行 操作。
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、 __________、 __________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
【答案】(1)蒸馏烧瓶 冷凝管 分液漏斗 容量瓶(共2分);(2)③④;(3) II 萃取和分液, I 蒸馏(共2.5分),(4)① 量筒、 100mL容量瓶、胶头滴管(共1.5分),② 2.7
③ BCD
【解析】
试题分析:(1)因①~④仪器的名称分别为:蒸馏烧瓶、冷凝管、分液漏斗、100mL容量瓶,
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;100mL容量瓶;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,故答案为:③④;
(3)碘在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开,则选择装置Ⅱ,然后再选择装置I进行蒸馏操作得到单质碘,故答案为:Ⅱ;萃取;分液;I;蒸馏;
(4)①)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
由提供的仪器可知还需要仪器有:100mL容量瓶、胶头滴管,
故答案为:10mL量筒;胶头滴管;100mL容量瓶;
②浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xL,所以xL×18.4mol/L=0.1LL×0.5mol/L,解得:x≈0.0027L=2.7mL,
mol/L=18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xL,所以xL×18.4mol/L=0.1LL×0.5mol/L,解得:x≈0.0027L=2.7mL,
故答案为:2.7;
③A.取浓硫酸时俯视,量取硫酸偏少,则配制溶液的浓度偏低,故A不选;
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中,量筒洗涤后,取硫酸偏大,则配制溶液的浓度偏大,故B选;
C.在烧杯中稀释浓硫酸后,立即转移,温度较高,定容后体积偏小,则配制溶液的浓度偏大,故C选;
D.定容时俯视,体积偏小,则配制溶液的浓度偏大,故D选;
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线,无影响,故D不选;
故答案为:BCD.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】物质应用与其性质密切相关。下列说法错误的是
A.硅胶可防止食物受潮是由于其具有吸水性
B.葡萄糖用于医疗输液是因为它属于强电解质
C.Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性
D.酸性重铬酸钾用于检查酒驾是利用其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 触摸试管情况 观察结果 反应完成所需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5min
块状 微热 反应较慢,火星红亮但木条未复燃 30min
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与 有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 .
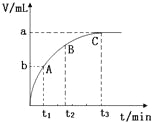
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论正确的是( )
①粒子半径:S2->Cl>S
②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S;
⑤酸性:H2SO4>HClO4
⑥碱性强弱:KOH>NaOH>Mg(OH)2
A. ① B. ③⑥ C. ②④⑥ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在强酸性溶液中能大量共存,且溶液为无色透明的一组是
A. NH4+、Ca2+、Al3+、Cl- B. Na+、CO32-、K+、NO3-
C. MnO4-、K+、SO42-、SO32- D. K+、SO42-、Cl-、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com