
 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.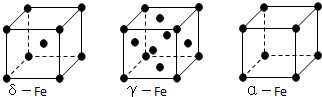
分析 (1)根据元素周期表电负性的递变规律比较电负性强弱;根据核外电子排布规律书写基态Fe原子的核外电子排布式;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化;
(3)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(4)N2与CN-为等电子体,根据氮气分子的电子式写出CN-的电子式,注意该微粒是离子;根据O22+的电子式 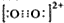 ,算出1mol O22+中含有的π键数目;
,算出1mol O22+中含有的π键数目;
(5)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;
(6)在配合物中的氯原子是不能自由移动的,但配离子中可以形成氯离子,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中.
解答 解:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,C的电负性最小,
基态Fe原子的核外价电子排布式为:[Ar]3d64S2,
故答案是:C;[Ar]3d64S2;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,
故答案为:sp2、sp3; ;
;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,
故答案为:>;
(4)N2与CN-为等电子体,氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为 ,根据氮气分子的电子式写出CN-的电子式,且CN-是离子,所以其电子式为:
,根据氮气分子的电子式写出CN-的电子式,且CN-是离子,所以其电子式为: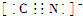 ,
,
根据等电子体原理可知,O22+的电子式 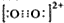 ,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,
,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,
故答案是: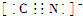 ;2NA;
;2NA;
(5)γ晶体晶胞中所含有的铁原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,
故答案为:4; 4:3.
(6)氯离子可以与银离子反应生成氯化银白色沉淀,通过沉淀的质量可以推断出氯离子的含量,发现原紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀为3mol,绿色晶体的水溶液反应得到的白色沉淀为2mol,两种晶体的组成皆为TiCl3•6H2O,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2•H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,
故答案为:[TiCl(H2O)5]Cl2•H2O.
点评 本题物质结构有关知识,涉及电负性大小比较、杂化理论的应用、等电子体、配合物的性质等知识,是对学生综合能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
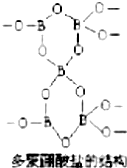 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com