
| A. | 主族元素的电负性越大,元素原子的第一电离能一定越大 | |
| B. | 在元素周期表中,元素电负性从左到右越来越小 | |
| C. | 在形成化合物时,电负性越小的元素越容易显正价 | |
| D. | 金属元素的电负性一定小于非金属元素的电负性 |
分析 A.元素的电负性大,第一电离能不一定大,如ⅡA和ⅤA的元素;
B.元素周期表中,元素电负性从左到右越来越大;
C.电负性越小说明对键合电子的吸引力越小,越易表现正化合价;
D.很多过渡金属电负性大于非金属元素
解答 解:A.元素的电负性大,第一电离能不一定大,如N元素的电负性小于氧元素的电负性,但N元素原子2p能级为半满稳定状态,第一电离能大于O元素,故A错误;
B.对于主族元素同周期自左而右,电负性越来越大,故B错误;
C.电负性小的元素在形成化合物时吸引电子的能力弱,元素的化合价为正值,电负性越小说明越容易显正价,故C正确;
D.很多过渡金属电负性大于非金属元素,故D错误;
故选C.
点评 本题考查元素电负性,第一电离能的递变规律,难度小,考生应注意其中的特例及考虑过渡元素.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
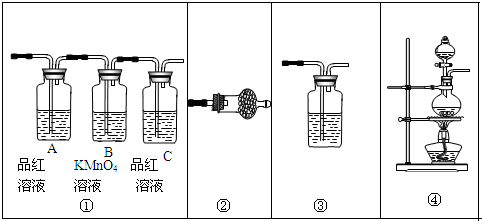
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、催化剂 | B. | 低温、低压、催化剂 | ||
| C. | 高温、高压、催化剂 | D. | 适宜温度、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
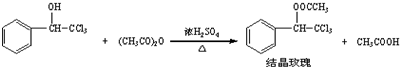
| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
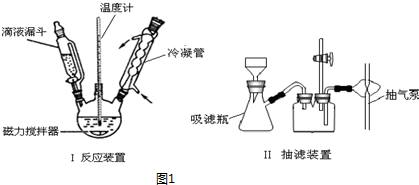
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
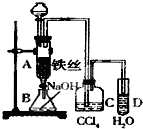 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com