
【题目】下列工业生产中不涉及电解原理的是( )
A. 燃料电池发电工业 B. 电镀工业
C. 电冶金工业 D. 氯碱工业
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于原子结构的叙述正确的是
A. 所有的原子核都是由质子和中子组成的
B. 原子的最外层电子数可以超过8个
C. 稀有气体的最外层电子数均为8
D. 所有主族元素的最外层电子数都等于其主族序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2 , 产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 , 原因是 .
(2)沉淀A的化学式为 , 该沉淀能否溶于稀盐酸? .
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s)+CO2(g)![]() 2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
A. ①③ B. ①②③④ C. ④② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线_____。
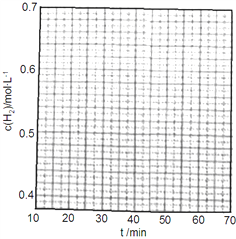
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是_____(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式______________________。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于__________(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
![]()
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海洋植物中提取碘的流程如下: ![]()
某化学兴趣小组将上述流程②③设计成如图所示实验.
已知:②中发生反应的化学方程式为Cl2+2KI═2KCl+I2 .
(1)写出提取流程中①③实验操作的名称:① , ③ .
(2)四氯化碳是无色、密度比水大的液体.F中下层液体的颜色为色,上层液体中溶质的主要成分为 .
(3)从F中得到碘单质还需进行的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是
A. 硝酸、生石灰、石灰石 B. 醋酸、纯碱、食盐
C. 盐酸、乙醇、硝酸钾 D. 硫酸、烧碱、碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将44.8LHCl气体溶于1L水中,所得盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为
A. 2mol/L B. 2.1mol/L C. 2.2mol/L D. 2.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com