
| A. | 1molCl2的体积为22.4L | |
| B. | 在0℃101KPa时,22.4L氢气中含有NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个CO和0.5molCH4的质量比为7:4 |
分析 A.气体的状态不确定;
B.标况下22.4L氢气的物质的量为1mol,1mol氢气含有2mol氢原子;
C.14g氮气的物质的量为0.5mol,含有1mol氮原子,含有7mol电子;
D.NA个一氧化碳分子的物质的量为1mol,质量为28g,0.5mol甲烷的质量为8g.
解答 解:A.气体的状态不确定,无法计算体积,故A错误;
B.在0℃,101kPa时,该条件为标况下,22.4L氢气的物质的量为1mol,1mol氢气含有2mol氢原子,含有2NA个氢原子,故B错误;
C.氮气中含有14个电子,14g氮气的物质的量为0.5mol,含有7mol电子,含有7NA个电子,故C正确;
D.NA个一氧化碳分子的物质的量为1mol,质量为28g;0.5mol CH4的质量为8g,二者比为28:8=7:2,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:选择题
| A. | 滴加硫酸酸化的FeSO4溶液,平衡不移动 | |
| B. | 溶液颜色保持不变时,该反应达到平衡状态 | |
| C. | 滴加6 mol/L NaOH溶液,溶液颜色变深 | |
| D. | 平衡常数表达式为K=$\frac{2c(Cr{{O}_{4}}^{2-})•2c({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})•c({H}_{2}O)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
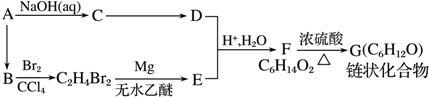
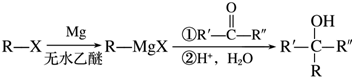 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | Cl- | C. | OH- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的酸性溶液:MnO4-、K+、Cl-、SO42- | |
| B. | 0.1 mol/LNaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| D. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com