
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
分析 某温度时,水的离子积为1×10-12 mol2•L-2,中性溶液中H+浓度为1×10-6mol•L-1,若该温度下某溶液中H+浓度为1×10-7 mol•L-1<1×10-6mol•L-1,可知溶液显碱性,以此来解答.
解答 解:某温度时,水的离子积为1×10-12 mol2•L-2,中性溶液中H+浓度为1×10-6mol•L-1,若该温度下某溶液中H+浓度为1×10-7 mol•L-1<1×10-6mol•L-1,可知溶液显碱性,OH-的浓度为$\frac{1×1{0}^{-12}}{1×1{0}^{-7}}$=1×10-5mol•L-1,则-]④[OH-]=100[H+],
故选A.
点评 本题考查溶液酸碱性的判断,为高频考点,把握水的电离平衡常数、氢离子的计算为解答的关键,侧重分析与计算能力的考查,注意中性溶液中离子浓度的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
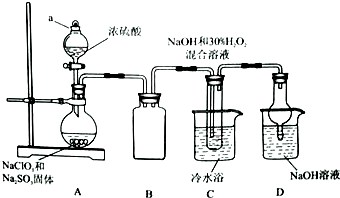 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
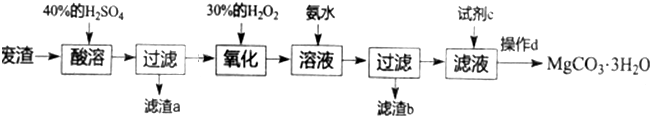
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com