


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件反应:2CO(g)?CO2(g)+C(s)可自发进行,则该反应的△H>0 | B、向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质 | C、在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA | D、相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸的体积比为____________。
(3)进行化学实验必须注意安全并符合仪器的使用要求。下列说法不正确的是____________。(填序号)
A.不慎将酸溅到眼中,应立即用水冲洗
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.如果苯酚浓溶液沾到皮肤上,应立即用酒精洗
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
E.在中学“硫酸铜晶体里结晶水含量测定”的实验中,称量操作至少需要四次
F.在250 mL烧杯中,加入216 mL水和
查看答案和解析>>
科目:高中化学 来源:2011-2012学年成都铁中高二3月检测化学试卷 题型:填空题
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高一上学期期末考试化学试卷 题型:填空题
(8分) 有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色。
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出。
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解。
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现。其中W溶液中气泡出现较快。
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成。
根据上述现象,回答下列问题:
(1)X的化学式为 ,Y的化学式为 ;
(2)写出下列有关反应的化学方程式或离子方程式。
①Z+石灰水(离子方程式) ;
②X+ CO2(化学方程式) ;
③W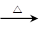 (化学方程式)
。
(化学方程式)
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com