
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1) 高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_______________________________
(2) 如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
① a处电极上发生的电极反应式是____________________________________________________
 ② 电镀结束后,装置Ⅰ中溶液的pH________(填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
② 电镀结束后,装置Ⅰ中溶液的pH________(填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③ 在此过程中若完全反应,装置Ⅱ中阴极质量变化1.28 g,则装置Ⅰ中理论上消耗甲烷_______L(标准状况下)。
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:( )
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列问题
(1)羟基的电子式 ,二氧化碳的电子式 ,乙酸中官能团的名称 丁烷同分异构体的结构简式
(2)苯和浓HNO3反应的化学方程式 ,反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:
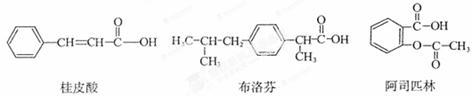
以下关于这三种有机物的说法中,不正确的是( )
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1 rnol阿司匹林最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将四个分别盛有足量硫酸铜溶液、氯化铜溶液、氢氧化钾溶液、氯化钠溶液的电解槽串联,用惰性电极电解一段时间后四个电解槽两极共产生气体在同温同压下的体积之比为( )
A.1:1:2:2 B. 1:2:3:4 C. 1:2:2:1 D.2:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](14分)
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是_______________________________
_______________________________________________________________________。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于吸热反应的是
A.CaO + H2O = Ca(OH)2 B.C + H2O  CO + H2
CO + H2
C.NaOH + HCl = NaCl + H2O D.2Mg + CO2 2MgO + C
2MgO + C
查看答案和解析>>
科目:高中化学 来源: 题型:
可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com