
| A. | 每一个水分子内含有两个氢键 | |
| B. | 水分子的空间构型为V形 | |
| C. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 水是良好的溶剂,易溶解HCl、CH4等气体 |
分析 A.水分子内不含有氢键,水分子间含有氢键;
B.水分子空间构型为V形;
C.H-O键的键能较大;
D.甲烷是非极性分子,难溶于极性溶剂水.
解答 解:A.水分子内不含有氢键,水分子间含有氢键,故A错误;
B.水分子中心原子是氧,价层电子对有2+2=4,省去2对孤对电子,空间构型为V形,故B正确;
C.氢键影响物质的物理性质,物质的稳定性取决于键能的大小,H-O键的键能较大,故H2O是一种非常稳定的化合物,故C错误;
D.甲烷是非极性分子,难溶于极性溶剂水,故D错误;
故选B.
点评 本题考查简单分子构型、氢键的存在及氢键对物质物理性质的影响,难度不大.要注意含有氢键的分子,熔沸点相对较高.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
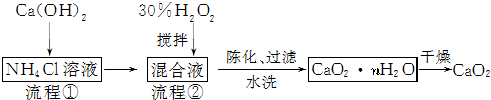

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开氢气中的H-H键 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | C与H2O(g)反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 | |
| B. | 煤炭经气化、液化和干馏等过程,可以转化为清洁燃料和化工原料 | |
| C. | PM2.5是指直径接近2.5×10-6m的颗粒物分散在空气中形成的污染物的胶体 | |
| D. | 门捷列夫在前人的基础上发现了元素周期律,表明科学研究既要继承又要创新 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
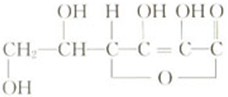 维生素C的结构式如下,
维生素C的结构式如下,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com