
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 饱和CO2溶液中:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CO32- |
分析 A.离子之间发生氧化还原反应,离子之间结合生成沉淀;
B.氯水中含氯气;
C.该组离子之间不反应;
D.加入金属铝产生H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.H+、I-、NO3-发生氧化还原反应,H+、SiO32-结合生成沉淀,不能共存,故A错误;
B.氯水中含氯气,与SO32-发生氧化还原反应,不能共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.加入金属铝产生H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中不能大量存在CO32-,碱溶液中不能大量存在NH4+,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
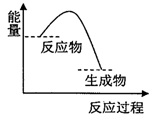
| A. | 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量 | |
| B. | 因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行 | |
| C. | 该图象可以表示碳酸钙受热分解的能量变化 | |
| D. | 该图象可以表示锌与稀硫酸反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
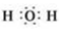 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中一定存在离子键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 分子晶体的水溶液一定不导电 | D. | 稀有气体能形成分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 液化石油气和天然气的主要成分都是烃 | |
| D. | 煤是由有机物和少量无机物组成的复杂混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
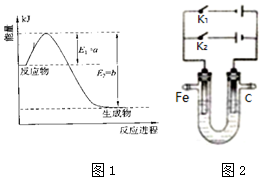 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加 X-的半径递增,还原性递减(用X表示卤素原子) | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐增强 | |
| C. | 单质与水反应均可表示为 X2+H2O═HX+HXO(用X表示卤素原子) | |
| D. | 单质的颜色随核电荷数的增加逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 提纯含有少量苯酚的苯 | 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀 |
| D | 检验蔗糖是否水解 | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com