

 .
. 分析 (1)元素周期表中,化学性质最活泼的金属在左下角,化学性质越活泼则金属性越强,非金属性最强的在右上角,溴单质在常温下是液体;
(2)根据元素的化合价确定化学式,甲烷中碳氢之间形成一对共用电子对.
解答 解:根据元素周期表中元素的分布知识,可以知道:根据元素周期表中元素的分布知识,可以知道:A是F,B是O,C是P,D是C,E是Ar,F是Cl,G是S,H是Al,K是Ca,L是K,G是Na,I是Mg,M处于d区,属于过渡元素,
(1)元素周期表中,从上到下金属的活泼性逐渐增强,从右到左金属活泼性逐渐增强,所以化学性质最活泼的金属在左下角,应该是K,化学性质越活泼则金属性越强,所以金属性最强的也是K,稀有气体元素化学性质是最稳定的,即Ar化学性质是最稳定,元素周期表中,从下到上元素的非金属性逐渐增强,从左到右非金属性逐渐增强,所以非金属性最强的在右上角,应该是F,溴单质在常温下是液体,属于过渡元素的是M,
故答案为:Ar;K;F;Br;M;
(2)根据元素的化合价确定化学式,B、C气态氢化物中O、P的化合价分别为-2、-3,所以它们的化学式分别为H2O、PH3,D的气态氢化物为CH4,它的结构式为 ,
,
故答案为:H2O、PH3; .
.
点评 本题考查学生元素周期律的应用知识,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:填空题
 常温下,浓度均为0.1mol•L-1的四种溶液:
常温下,浓度均为0.1mol•L-1的四种溶液:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
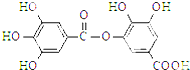
| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
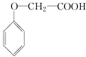 发生化学反应的产物.
发生化学反应的产物. 、
、 等.
等.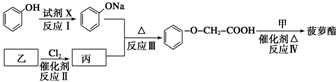
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com