
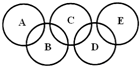
 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: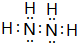 .
.分析 A是沼气的主要成分,则A为甲烷;C可作为光导纤维的主要材料,则C为SiO2;B分子中所含电子数为18,B不稳定,具有较强的氧化性,含甲烷、二氧化硅中含有的元素,可知B为H2O2;E分子中所含电子数为18,结合E的结构模型,可知E是由六个原子构成的分子,原子平均电子数为3,故E中含有H元素,E为N2H4;D中含有Si元素,还含有H元素或N元素,由D中所含的两种元素的原子个数之比为3:4,故D为Si3N4.
解答 解:A是沼气的主要成分,则A为甲烷;C可作为光导纤维的主要材料,则C为SiO2;B分子中所含电子数为18,B不稳定,具有较强的氧化性,含甲烷、二氧化硅中含有的元素,可知B为H2O2;E分子中所含电子数为18,结合E的结构模型,可知E是由六个原子构成的分子,原子平均电子数为3,故E中含有H元素,E为N2H4;D中含有Si元素,还含有H元素或N元素,由D中所含的两种元素的原子个数之比为3:4,故D为Si3N4.
(1)B为H2O2,属于二元弱酸,其水溶液显弱酸性,则H2O2在水溶液的第一步电离方程式可表示为:H2O2?HO2-+H+,
故答案为:H2O2?HO2-+H+;
(2)D的化学式是Si3N4,E为N2H4,电子式为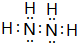 ,
,
故答案为:Si3N4;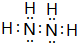 ;
;
(3)液态H2O2与液态N2H4反应可生成一种气态单质和一种常见液体,应生成氮气与水,1molH2O2参加反应放出热量QkJ,其反应的热化学方程式:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2Q kJ/mol,
故答案为:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2Q kJ/mol;
(4)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.N2H4与NH3分子类似,也可与HCl发生反应,N2H4与足量盐酸发生反应的化学方程式:N2H4+2HCl=N2H6Cl2,
故答案为:N2H4+2HCl=N2H6Cl2.
点评 不同考查物质的推断、常用化学用语,掌握常见18电子物质是推断的关键,熟练掌握常见物质的结构与性质,难度中等.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
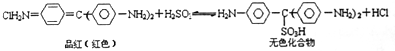
| A. | 品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能在同一平面上 | |
| D. | 无色化合物中的官能团有苯环、磺酸基、氨基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
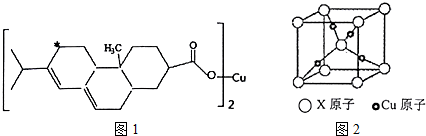
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷的外围电子排布式:3d104S24p3 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 过氧化钠的电子式: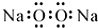 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
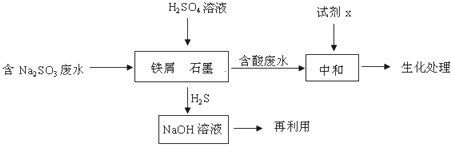
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com