
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面.19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外.由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替.索尔维法的生产流程如下:
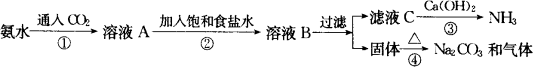
索尔维法能实现连续生产,但其食盐利用率只有70%,且所得副产品CaCl2没有用处,污染环境.
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品.氯化铵主要用作氮肥.侯德榜制碱法的原理是:
①在30~50℃的饱和食盐水中,先通入氨至饱和再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水.
据此回答下列问题:
(1)标出反应Na2SO4+2C![]() Na2S+2CO2↑的电子转移方向和数目.
Na2S+2CO2↑的电子转移方向和数目.
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①________;②________;
③________;④________.
(3)写出侯德榜制碱法第①步反应的化学反应方程式________.
(4)在索尔维制碱法中________物体可循环利用.
(5)在侯德榜制碱法中________物体可循环利用.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面。19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3====CaS+Na2CO3
这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外。由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替。索尔维法的生产流程如下:

索尔维法能实现连续生产,但其食盐利用率只有75%,且所得副产品CaCl2没有用处,污染环境。
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品。氯化铵主要用作氮肥。侯德榜制碱法原理是:
①在30~50 ℃的饱和食盐水中,先通入氨至饱和,再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15 ℃,使NH4Cl沉淀,滤液为饱和食盐水。
据此回答下列问题:
(1)标出反应Na2SO4+2C![]() Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①_________________________
②_________________________
③_________________________
④_________________________
(3)写出侯德榜制碱法第①步反应的化学方程式_________________________
(4)在索尔维制碱法中____________物质可循环利用。
(5)在侯德榜制碱法中____________物质可循环利用。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH-个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
(2)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(3)常温下,现有pH均为11的标签模糊的NaOH和Na2CO3溶液,则NaOH溶液中由水电离出来的OH-浓度为Na2CO3溶液中水电离出来OH-浓度的 倍。丙同学设计如下实验予以区别:各取1mL两种溶液加水稀释至1L,分别测定其pH。请问丙同学是如何判断哪瓶溶液为Na2CO3溶液? ;丁同学各取1mL两种溶液,分别滴加少量AlCl3溶液观察有无沉淀或气体进行鉴别,则溶液滴加后同时产生沉淀和气体的反应离子方程式为 。
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.400 mol·L-1的Na2CO3溶液和0.200 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市龙湾区龙湾中学高二期中考试化学试卷(带解析) 题型:实验题
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
| A.溶液中水电离出的OH-个数:②>① | B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)>c(H2CO3) | D.②溶液中:c(HCO3-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com