
| A. | Zn | B. | Cu | C. | Fe | D. | Mg |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
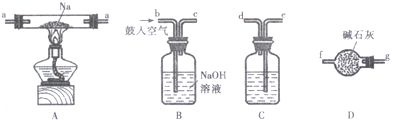
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为H2(或O2). | 将b中剩余气体通过灼热的氧化铜 (或将b中剩余气体通过灼热的铜网). | 若看到黑色固体变红(或红色固体变黑), 证明此猜想正确,反之则不正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙和磷都是人体内含量丰富的矿物元素,属于常量元素 | |
| B. | 白色污染是指聚乙烯、聚氯乙烯等各种废塑料制品造成的污染 | |
| C. | 具有强吸附性的活性炭能吸附某些溶于水中的杂质,并能对水进行消毒 | |
| D. | 青霉素等抗生素对某些微生物有抑制或杀灭作用,但对人体细胞的毒性很低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
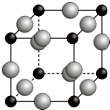 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
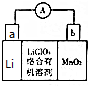 锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题: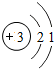 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: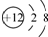 | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | H2O2的电子式: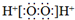 | |
| D. | 硫酸的电离方程式:H2SO4═H22++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com