
 ,
, 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原电池中电子由负极流向正极 |
| B.原电池中发生还原反应的电极是正极 |
| C.电解池中发生还原反应的电极是阳极 |
| D.电解池中质量增加的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
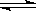 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2+2e-=2I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C+CO2=2CO |
| B.Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3?H2O+8H2O |
| C.CaC2+2H2O=Ca(OH)2+C2H2 |
| D.CH4+2O2=CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaSO3(s)+4C(s)=BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H>0 |
| B.纯铁和生铁在酸雨中均发生电化学腐蚀 |
C. ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.0.1mol·L-1Na2CO3溶液在35℃时碱性比25℃强,说明盐类水解反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com