
化学平衡原理是中学化学学习的重要内容,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气(主要成分CO、H2)制备甲醇。
(1)己知:CO、H2、CH3OH、的燃烧热(△H)分别为-283.0kJ/mol、-241.8kJ/mol、-192.2 kJ/mol,请写出合成气制备甲醇的热化学方程式 。
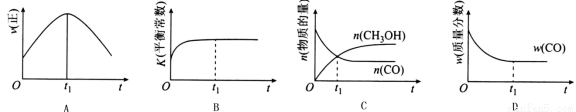
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是______(填选项字母)。
(3)在T1℃时,在体积为5 L的恒容容器中充入3 mol的合成气,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。H2和CO按2:1投入时经过5 min达到平衡,则5 min内用H2表示的反应速率为v(H2)=_______。温度不变,当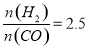 时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的______点。
(4)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:________________________。
(5)水的自偶电离可表示为H2O+H2O H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
H3O++OH-。与水电离相似,甲醇也能发生自偶电离,请写出甲醇的自偶电离方程式_______________________________________,往甲醇中加入少量金属钠反应生成甲醇钠,则反应后的混合液中的电荷守恒式_____________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.原子半径:A>B>C>D
D.单质还原性:B>A,单质氧化性:D>C
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列有关实验原理、操作或现象不正确的是( )
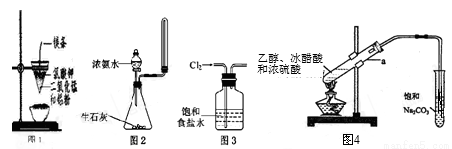
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.实验室用图4所示装置制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
2Zn(OH)2•ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2•ZnCO3的工艺流程如下:
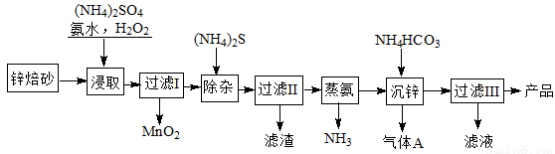
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
甲、 乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图。其中甲和X可能是( )
乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图。其中甲和X可能是( )
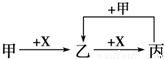
A.甲为Fe、X为Cl2
B.甲为S、X为O2
C.甲为SO2、X为NaOH溶液
D.甲为AlCl3溶液、X为NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg 3Fe+4MgS,装置如图所示。下列说法不正确的是
3Fe+4MgS,装置如图所示。下列说法不正确的是

A.放电时,镁电极为负极
B.充电时,阴极的电极反应式为MgS+2e-=Mg+S2-
C.放电时, A极质量减少
D.图中所示离子交换膜应使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2016届福建厦门外国语学校高三5月月考理综化学试卷(解析版) 题型:填空题
研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。


①写出总反应化学方程式 。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是 反应(填“吸热”或“放热”)。
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式 。
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。


①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式 。
②溶液的pH对NO去除率影响的原因是 。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2。列式计算实验中NO除去率 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
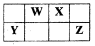
A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
下列各组物质中,不能按a→b→c关系相互转化的是(“→”表示一步完成)
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Na | Na2O2 | NaOH |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com