
ijȼ�ϵ�صĵ������ҺΪϡ���ᣬ�ֱ�������ͨ�����壬����������⣮
(1)���ֱ�ͨ��CO��O2ʱ��
��������Ӧʽ��________��
�ڸ�����Ӧʽ��________��
�۵���ܷ�Ӧʽ��________��
�ܵ������Һ��H+Ũ�ȵı仯��________(���������С�����䡱)��
(2)���ֱ�ͨ��H2S��Cl2ʱ��
��������Ӧʽ��________��
�ڸ�����Ӧʽ��________��
�۵���ܷ�Ӧʽ��________��
�ܵ������Һ��H+Ũ�ȵı仯________(���������С�����䡱)��
 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���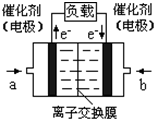 ��ͼ����a��ͨ�����
��ͼ����a��ͨ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 Cu��OH��2+2H+
Cu��OH��2+2H+ Cu��OH��2+2H+
Cu��OH��2+2H+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��H1-��H 2 |
| 2 |
| ��H1-��H 2 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
2009��12��7�ա�18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�顣����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
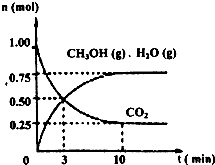
��1��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2L���ܱ������У�����1mol CO2��3.25mol H2����һ�������·�����Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ�����n����ʱ��仯����ͼ��ʾ��

�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ��
![]() (H2)=_______��
(H2)=_______��
�����д�ʩ��һ������ʹ![]() (CH3OH)/ (CO2)�������_____��
(CH3OH)/ (CO2)�������_____��
A�������¶� B����С�������ݻ�
C����ˮ��������ϵ�з��� D��ʹ�ø���Ч�Ĵ���
��2�����³�ѹ�£�����CO2ˮ��Һ��pH=5.6��c(H2CO3)=1.5��10-5 mol��L-1��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3![]() HCO3����H���ĵ���ƽ�ⳣ��K=___________������֪��10-5.6=2.5��10-6����
HCO3����H���ĵ���ƽ�ⳣ��K=___________������֪��10-5.6=2.5��10-6����
��3����״���£���1.12L CO2ͨ��100mL 1mol��L-1��NaOH��Һ�У�������Һ������Ũ���ɴ�С��˳��Ϊ
________________��
��4����ͼ���Ҵ�ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľṹʾ��ͼ����a����ͨ�����_____________����Ҵ���������������b���缫�Ϸ����ĵ缫��Ӧ��___________
__________________________________________��

��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10-4mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��13 �֣�
��1��CuSO4��Һ����ѧ��ѧ����ũҵ�����г�����һ���Լ���ijͬѧ����CuSO4��Һ����������ʵ��̽����
�� ͼһ�Ǹ��ݷ�ӦZn + CuSO4 = Cu + ZnSO4��Ƴɵ�пͭԭ��ء�����ʼ���Һ�� ���ZnSO4����CuSO4������Һ��Cu���ĵ缫��Ӧʽ�� ��
��ͼ���У����Ǽ���ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľṹʾ��ͼ����ͬѧ���ڢ���ʵ�����϶�ͭ����b��ͨ����� ���CH4����O2������a���缫�Ϸ����ĵ缫��Ӧʽ�� ��
��2����������CuSO4��5H2O������ʯ�Һ�ˮ��һ��������ϣ����ɵõ�������Һ��ɱ���������� ��Ч�ɷ�Ϊ���ܵļ�ʽ����ͭ[xCuSO4��yCu��OH��2]��Ϊ�ⶨij��ʽ����ͭ����ɽ���������ʵ�飺ȡ�������ļ�ʽ����ͭ��Ʒ���ݣ�һ�ݵμ�ϡ������ǡ����ȫ�ܽ⣬��һ�ݸ������պ�ֻ�õ�CuO���塣����������ʾn��HCl���Un��CuO����3�U2����ü�ʽ����ͭ�Ļ�ѧʽ��x�Uy= ��
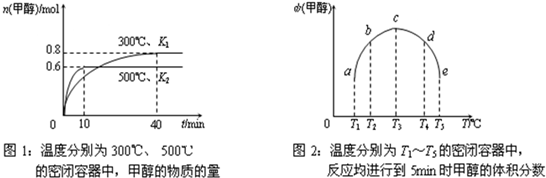
��3��E�Ƿǽ�������ǿ��Ԫ�أ�M��E����̬�⻯��ڹ̶�������ܱ������У�����M�������¹�ϵ��
xM(g)![]() Mx(g)����Ӧ�������������ʵ�����ʱ��ı仯��ϵ����ͼ���� ��˵����ȷ����
Mx(g)����Ӧ�������������ʵ�����ʱ��ı仯��ϵ����ͼ���� ��˵����ȷ����
A���÷�Ӧ�Ļ�ѧ����ʽ��2HF![]() (HF)2
(HF)2
B��ƽ��ʱ��������ƽ��Ħ��������33.3
C��t1ʱ�̣������¶Ȳ��䣬�ٳ���1molM�����´ﵽƽ��ʱ�� ������
������
D��M�ķе��ͬ������һ����Ԫ�ص���̬�⻯��е��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com