
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
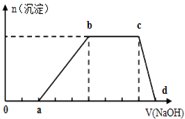 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:查看答案和解析>>
科目:高中化学 来源: 题型:
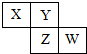
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
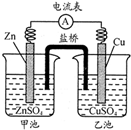 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NO2通入FeSO4溶液中不会有明显现象 |
| B、2L 0.5mol/L的盐酸和1L 0.5mol/L的硫酸PH相等 |
| C、饱和氯水中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下反应的△H不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0~t1时间内,v(Y)=
| ||
| C、M点的正反应速率V正大于N点的逆反应速率V逆 | ||
| D、M点时再加入一定量X,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com