
| A. | Cl2通入水中 | B. | Cl2通入水Na2SO3溶液中 | ||
| C. | 二氧化硫通入氯水中 | D. | NO2通入水中 |
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12O的醇能够被催化氧化生成醛,该醇的同分异构体有4种 | |
| B. | 将苯、溴水和铁屑混合制溴苯 | |
| C. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,且互为同分异构体 | |
| D. | 若不考虑立体异构,分子式为C4H8O2且为酯的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 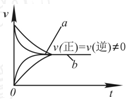 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 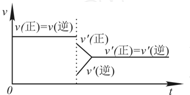 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物X的分子式为Cl2H15O | |
| B. | X分子不能使酸性高锰酸钾溶液褪色 | |
| C. | X分子中一定在同一个平面内的碳原子最多6个 | |
| D. | 在Ni作催化剂的条件下,1molX最多能与4molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有吸附性 | |
| B. | 溶解度大于CuS、PbS、CdS | |
| C. | 溶解度小于CuS、PbS、CdS | |
| D. | MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
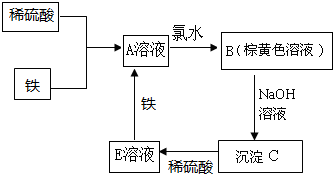 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com