
| ||
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1molCl2,转移电子的物质的量为2mol |
| C、每消耗1molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
| ||


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体 |
| B、增大压强,平衡不移动,说明B、D必是气体 |
| C、若B是气体,增大A的浓度会使B的转化率增大 |
| D、升温,C的质量分数减小,说明逆反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 |
| B、单质的颜色随核电荷数的增加而加深 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 原电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
| D | 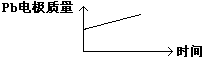 | 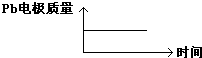 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(O2)=0.01mol?L-1?s-1 |
| B、V(NO)=0.008mol L-1?s-1 |
| C、V(H2O)=0.015mol L-1?s-1 |
| D、V(NH3)=0.002mol L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、作质谱分析,质谱图中质荷比的最大值为46 |
| B、作红外光谱分析,谱图上有C-H、C-O和O-H键的吸收峰 |
| C、作核磁共振氢谱分析,在谱图中出现3个吸收峰,其强度比为3:2:1 |
| D、向CH3-CH2-OH中加入金属钠,有H2放出,证明该有机物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 | ||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | ||||
C、Cu
| ||||
| D、Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com