
下列有关物质的性质和应用正确的是( )
A.在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀
B.二氧化硅具有半导体性能,可以制成光电池
C.二氧化氯(ClO2)和臭氧可用作自来水消毒剂
D.油脂水解可得到氨基酸和甘油
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学指导冲关 第10练常见有机化合物及其应用练习卷(解析版) 题型:选择题
某化合物的分子式为C5H12,则该化合物的一氯代物的种数(不考虑立体异构)可能是( )
A.1种 B.2种 C.8种 D.4种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:选择题
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.所有元素原子的最外层电子数都等于元素的最高化合价
B.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
C.多电子原子中,在离核较近的区域内运动的电子能量较高
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
阿伏加德罗常数为NA,下列说法中正确的是( )
A.62 g Na2O溶于水后所得溶液中含有的O2-数为NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA
C.常温常压下,16 g甲基(—13CH3)所含的中子数为10NA
D.0.5 mol Cu和足量浓硝酸反应可以生成22.4 L NO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练3 元素及其化合物练习卷(解析版) 题型:选择题
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是( )
选项实验现象解释或结论
A加入FeCl3固体溶液变成红褐色FeCl3的水解程度变大
B加入等体积水溶液颜色变浅c(Fe3+)变小
C加入足量Fe粉溶液颜色变成浅绿色2Fe3++Fe=3Fe2+
D将FeCl3溶液微热溶液变成红褐色水解反应
ΔH>0
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:填空题
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
A.升高温度
B.加入高效催化剂
C.将XQ3及时分离出去
D.增大反应体系压强
E.增大反应物浓度
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的NaHA溶液pH=1,则有:c(Na+)=c(H2A)+c(HA-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:选择题
据报道,科学家研制出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )
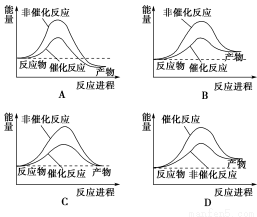
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。
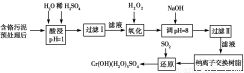
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:
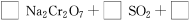
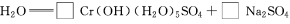 ;
;
生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com