
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
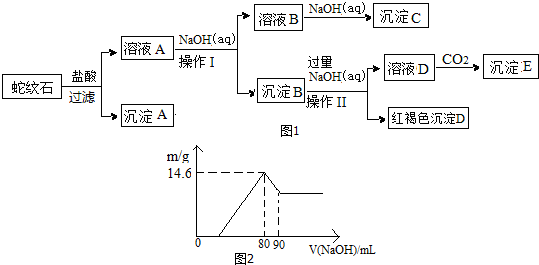
分析 蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成与盐酸充分反应后再过滤得到滤液A含有氯化镁、氯化铁、氯化铝,沉淀A为SiO2,溶液A中加入氢氧化钠溶液控制溶液PH4.7-9.4,促使铝离子、铁离子全部沉淀,镁离子不沉淀;所以沉淀B为Fe(OH)3,Al(OH)3,加入过量氢氧化钠过滤得到彻底为红褐色氢氧化铁沉淀,溶液为偏铝酸钠溶液,通入二氧化碳反应生成沉淀E为Al(OH)3,溶液B是氯化镁溶液,加入氢氧化钠溶液反应生成氢氧化镁沉淀.
(1)依据过滤操作选择玻璃仪器;
(2)向溶液A中逐滴加入NaOH溶液控制溶液中铁离子和铝离子全部沉淀,镁离子不沉淀;
(3)偏铝酸钠溶液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢盐;
(4)图象分析氢氧化铝消耗氢氧化钠溶液体积10ml,计算得到氢氧化铝沉淀质量,14.6g减去氢氧化铝沉淀质量为氢氧化铁沉淀质量,结合元素守恒计算Fe2O3与Al2O3的物质的量之比;
解答 解:蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成与盐酸充分反应后再过滤得到滤液A含有氯化镁、氯化铁、氯化铝,沉淀A为SiO2,溶液A中加入氢氧化钠溶液控制溶液PH为4.7-9.4,促使铝离子、铁离子全部沉淀,镁离子不沉淀;所以沉淀B为Fe(OH)3,Al(OH)3,加入过量氢氧化钠过滤得到彻底为红褐色氢氧化铁沉淀,溶液为偏铝酸钠溶液,通入二氧化碳反应生成沉淀E为Al(OH)3,溶液B是氯化镁溶液,加入氢氧化钠溶液反应生成氢氧化镁沉淀;
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
故答案为:烧杯、玻璃棒、漏斗;
(2)根据上面的分析可知,沉淀B为Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液控制溶液中铁离子和铝离子全部沉淀,镁离子不沉淀,分析图表数据液A中加入氢氧化钠溶液控制溶液PH为4.7-9.4,促使铝离子、铁离子全部沉淀,镁离子不沉淀;所以沉淀B为Fe(OH)3,Al(OH)3,控制溶液pH在4.7-9.4范围内可得到符合图1关系的沉淀B,故选C.
故答案为:Al(OH)3、Fe(OH)3;C;
(3)偏铝酸钠溶液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢盐,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)图象分析氢氧化铝消耗氢氧化钠溶液体积10ml,5mol•mol-1NaOH溶液,溶解氢氧化铝反应Al(OH)3+OH-=AlO2-+H2O,n(Al(OH)3)=0.010L×5mol•mol-1=0.05mol,计算得到氢氧化铝沉淀质量=0.05mol×78g/mol=3.9g,氢氧化铁沉淀质量=14.6g-3.9g=10.7g,结合元素守恒计算Fe2O3与Al2O3的物质的量之比=$\frac{10.7g}{107g/mol}$×$\frac{1}{2}$:0.05×$\frac{1}{2}$=2:1;
故答案为:2:1.
点评 本题考查了物质分离的方法和流程分析判断,掌握物质性质和题干信息是解题关键,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
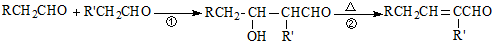

 ,B
,B .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$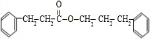 +H2O.
+H2O. 、
、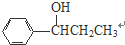 、
、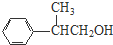 、
、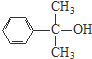 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
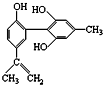 的说法正确的是( )
的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=② | B. | ①<② | C. | ①>② | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com