
| A.0 | B.1 | C.2 | D.3 |
科目:高中化学 来源:不详 题型:单选题
 纳米颗粒的总反应如下:
纳米颗粒的总反应如下: 
 ===
=== 。下列说法正确的是
。下列说法正确的是| A.在反应中硫元素被氧化,铁元素被还原 | B.还原剂是 氧化剂是 氧化剂是 和 和 |
C.每生成1 mol  转移3 mol电子 转移3 mol电子 | D.当转移1 mol电子时,消耗56 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( ) | A.3∶1 | B.1∶3 | C.2∶1 | D.1∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
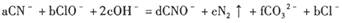
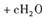 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:| A.0.5 | B.1 | C.2 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 罗马数字表示元素的价态)的沉淀。处理含 1 mol Cr2O72-的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是
罗马数字表示元素的价态)的沉淀。处理含 1 mol Cr2O72-的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是| A.x= 0.5 , a=" 8" | B.x = 0.5 , a="10" |
| C.x = 1.5 , a=" 8" | D.x = 1.5 , a= 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2 | B.H2 | C.NH3 | D.NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com