
分析 X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;
Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%,则Y位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素;
Z元素和N元素在同一族,则Z为P元素,
依据分析可知:X是Cl元素,Y是S元素,Z为P元素,再结合元素化合物知识解答.
解答 解:(1)①X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;Y元素的气态氢化物是H2Y,则Y位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素;Z元素和氮元素在同一族,则Z为P元素,
依据分析可知:X是Cl元素,Y是S元素,Z为P元素,
故答案为:Cl;S;P;
②X为Cl元素,Cl的最高价为+7价,Cl的最高价氧化物为Cl2O7,其对应的水化物为高氯酸:HClO4;
Y为S元素,S的最高价为+6价,S的最高价氧化物为SO3,其对应的水化物为硫酸:H2SO4;
Z为P元素,P的最高价为+5价,则P的最高价氧化物为P2O5,其对应的水化物为磷酸:H3PO4,
故答案为:HClO4;H2SO4;H3PO4;
③16号的硫,有三个电子层,最外层6个电子,所以位于第三周期第VIA族,故答案为:第三周期第VIA族.
点评 本题主要考查了元素位置结构性质关系的相互应用,熟悉原子结构及物质的性质是解本题关键,根据反应现象、原子结构确定元素,再结合元素化合物的性质来分析解答.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
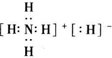 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: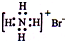 | |
| B. | CO2的比例模型: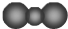 | |
| C. | CCl4分子构型为正四面体,其键与键之间的夹角为109°28′ | |
| D. | 中子数为20的氯原子:20Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )| A. | ①③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=0.001mol•L-1 | B. | 溶液中c(H+ )=10-11 mol•L-1 | ||
| C. | 由水电离出的c(H+ )=0.1mol•L-1 | D. | c(HCO3-)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
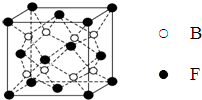 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)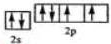 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族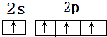 ,不符合能量最低原理原理.
,不符合能量最低原理原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com